Как епигенетичната модификация с CRISPR-Cas9 революционизира подмладяването на индуцирани плурипотентни стволови клетки (iPSC) — Дълбочинно проучване в науката и бъдещия потенциал
- Въведение в подмладяването на iPSC и епигенетичната модификация
- CRISPR-Cas9: Механизми и иновации в епигенетичното редактиране
- Ключови епигенетични цели за подмладяване на iPSC
- Наскоро постигнати напредъци: Казуси и експериментални резултати
- Предизвикателства и ограничения в епигенетичната модификация с CRISPR-Cas9
- Терапевтични импликации и приложения в регенеративната медицина
- Етични съображения и регулаторен ландшафт
- Бъдещи насоки: Възникващи технологии и изследователски фронтове
- Заключение: Пътят напред за подмладяване на iPSC чрез CRISPR-Cas9
- Източници и референции
Въведение в подмладяването на iPSC и епигенетичната модификация
Индуцираните плурипотентни стволови клетки (iPSCs) са соматични клетки, пренастроени в плурипотентно състояние, което им позволява да се диференцират в различни клетъчни типове и предлага огромен потенциал за регенеративна медицина и моделиране на заболявания. Въпреки това, iPSCs често запазват остатъчна епигенетична памет от клетките на произход, което може да ограничи тяхното пълно подмладяване и диференциране. Епигенетичната модификация — промяна на химични модификации на ДНК или хистони без промяна на основния генетичен код — се е утвърдила като обещаваща стратегия за подобряване на подмладяването на iPSC чрез нулиране на тези епигенетични маркери до по-ембрионоподобно състояние.
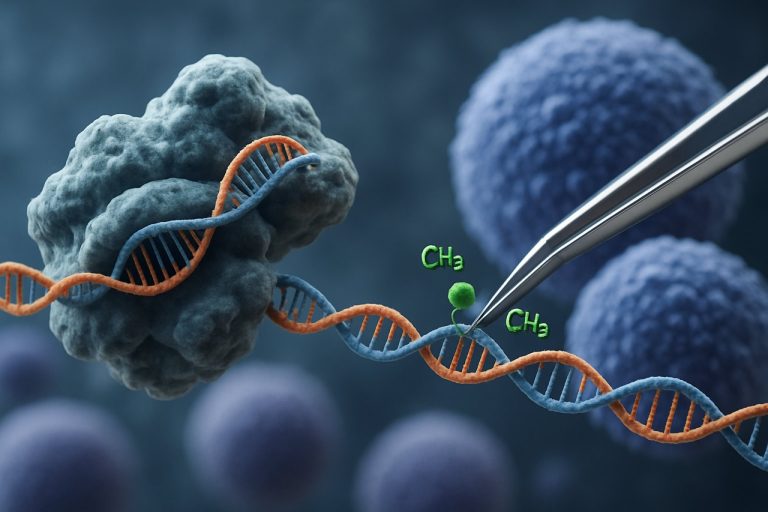
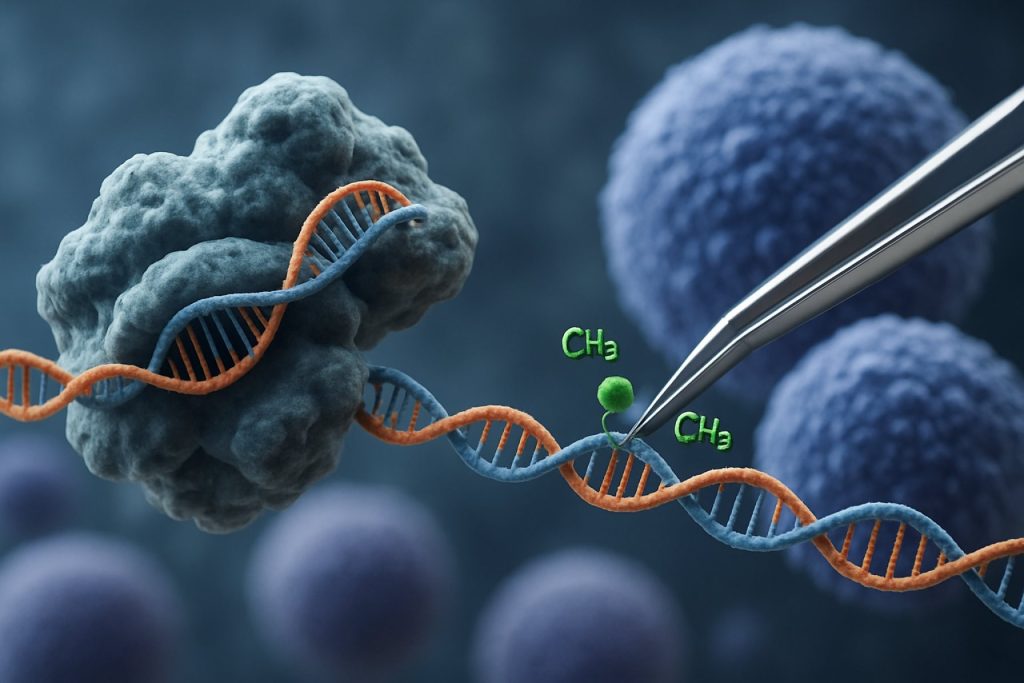
Появата на технологията CRISPR-Cas9 революционизира областта на епигенетичното редактиране. За разлика от традиционните приложения на CRISPR, които предизвикват двуверижни разкъсвания за редактиране на гени, епигенетичната модификация, базирана на CRISPR, използва катализаторно неактивен Cas9 (dCas9), свързан с епигенетични ефекторни домейни. Тази система позволява прецизно, локус-специфично модифициране на епигенетични маркери, като метилиране на ДНК или ацетилиране на хистони, позволявайки целенасочено пренастройване на профилите на генната експресия в iPSCs. Такива целенасочени интервенции могат да изтрият свързаните с възрастта или специфични за линията епигенетични подписи, насърчавайки по-пълно подмладяване на iPSCs и подобрявайки техните функционални свойства.
Наскоро проведени изследвания демонстрират осъществимостта на използването на системи CRISPR-dCas9 за модифициране на ключови гени, свързани с подмладяването, и епигенетични регулатори в iPSCs, прокарвайки пътя за по-ефективни и безопасни терапии с стволови клетки. С напредването на полето, интеграцията на епигенетичната модификация с CRISPR-Cas9 с технологията iPSC носи значителни обещания за преодоляване на текущите ограничения в клетъчното пренастройване и за разработването на персонализирани подходи в регенеративната медицина (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9: Механизми и иновации в епигенетичното редактиране
Системата CRISPR-Cas9, първоначално разработена за прецизно редактиране на генома, е иновативно адаптирана за целенасочена епигенетична модификация, предлагайки нови възможности за подмладяване на индуцираните плурипотентни стволови клетки (iPSCs). За разлика от традиционния CRISPR-Cas9, който въвежда двуверижни разкъсвания за редактиране на ДНК последователности, епигенетичното редактиране използва катализаторно неактивен Cas9 (dCas9), свързан с епигенетични ефекторни домейни. Това позволява локус-специфично модифициране на състоянията на хроматина — като метилиране на ДНК или ацетилиране на хистони — без да променя основния генетичен код. Такава прецизност е от съществено значение за подмладяването на iPSC, където нулирането на епигенетичния ландшафт може да възстанови младежки профили на генната експресия и да подобри клетъчната функция.
Наскоро иновации включват dCas9, свързан с метилтрансферази или деметилази, както и с ацетилтрансферази или деацетилази, позволявайки обратимо активиране или потискане на целеви гени, свързани с остаряването и сенесценцията. Например, целенасочената деметилация на промотори за гени на плурипотентност може да реактивира тяхната експресия, подобрявайки качеството на iPSC и потенциала за диференциране. Освен това, многопластовото епигенетично редактиране — едновременно насочване на множество локуси — е демонстрирано, допълнително подобрявайки процеса на подмладяване чрез организиране на сложни мрежи за регулация на гените Nature Reviews Genetics.
Тези напредъци се допълват от подобрени системи за доставка, като рибонуклеопротеинови комплекси и вирусни вектори, които увеличават ефективността на редактиране и намаляват страничните ефекти. В съвкупност, епигенетичното редактиране, базирано на CRISPR-Cas9, представлява трансформиращ подход за подмладяване на iPSC, с потенциала да преодолее ограниченията на конвенционалното пренастройване и да прокара пътя за регенеративни терапии Cell Stem Cell.
Ключови епигенетични цели за подмладяване на iPSC
Критичен аспект на използването на CRISPR-Cas9 за епигенетична модификация в подмладяването на индуцирани плурипотентни стволови клетки (iPSC) е идентифицирането и целенасочването на ключови епигенетични регулатори, които управляват клетъчното стареене и плурипотентността. Сред най-значимите цели са моделите на метилиране на ДНК, модификациите на хистони и локусите на некодираща РНК, всички от които играят основна роля в поддържането или изтриването на клетъчната памет по време на пренастройване. Например, статусът на метилиране на промотора на p16INK4a, известен маркер за сенесценция, е показан да влияе на пролиферативния капацитет и потенциала за подмладяване на iPSCs. Системите CRISPR-dCas9, свързани с деметилази или метилтрансферази, могат да бъдат точно насочени към такива локуси, за да модифицират тяхното епигенетично състояние, като по този начин увеличават ефективността на пренастройване и клетъчната младост Nature Reviews Genetics.
Друг ключов цел е регулацията на модификациите на хистони, като H3K9me3 и H3K27me3, които са свързани с образуването на хетерохроматин и потискането на гените. Целенасоченото редактиране на тези маркери в специфични геномни региони с помощта на CRISPR-dCas9, свързан с ензими, модифициращи хистони, може да реактивира гените на плурипотентност или да потисне гени, свързани с остаряването, улеснявайки по-robust процес на подмладяване Cell Stem Cell. Освен това, дългите некодиращи РНК (lncRNA), които модифицират архитектурата на хроматина и генната експресия, се появяват като обещаващи цели за CRISPR, за да се настрои епигенетичният ландшафт на iPSCs Nature Cell Biology.
Общо взето, стратегическият избор и прецизното модифициране на тези епигенетични цели с помощта на инструменти, базирани на CRISPR-Cas9, носят значителни обещания за напредък в подмладяването на iPSC и разработването на регенеративни терапии.
Наскоро постигнати напредъци: Казуси и експериментални резултати
През последните години бяха наблюдавани значителни напредъци в използването на епигенетичната модификация, базирана на CRISPR-Cas9, за подмладяване на индуцираните плурипотентни стволови клетки (iPSCs). Забележително е, че няколко изследвания демонстрираха осъществимостта на използването на катализаторно неактивен Cas9 (dCas9), свързан с епигенетични модификатори, за целенасочване и пренастройване на специфични хроматинови региони, като по този начин се обръщат свързаните с възрастта епигенетични маркери в iPSCs. Например, знаково проучване от Nature докладва за използването на dCas9-TET1 за деметилиране на промоторните региони на ключови гени на плурипотентност, което доведе до подобрена ефективност на пренастройване и подобрени маркери на клетъчното подмладяване.
Друг важен експеримент, публикуван от Cell Stem Cell, използва dCas9-p300 за ацетилиране на хистон H3K27 в локуси, свързани с младежки профили на генната експресия. Това целенасочено епигенетично редактиране не само възстанови младежките транскрипционни подписи, но също така подобри митохондриалната функция и намали фенотипите, свързани с сенесценцията в iPSCs, получени от възрастни донори.
Освен това, наскоро проведено предклинично проучване от Science демонстрира, че многопластовото епигенетично редактиране с CRISPR-dCas9 може едновременно да модифицира множество пътища, свързани с остаряването, водещи до синергични ефекти върху подмладяването на iPSC. Тези находки колективно подчертават потенциала на епигенетичната модификация с CRISPR-Cas9 като прецизен и универсален инструмент за обръщане на клетъчното стареене в iPSCs, прокарвайки пътя за бъдещи транслационни приложения в регенеративната медицина и моделирането на заболявания, свързани с възрастта.
Предизвикателства и ограничения в епигенетичната модификация с CRISPR-Cas9
Въпреки трансформиращия потенциал на епигенетичната модификация, базирана на CRISPR-Cas9, в подмладяването на индуцираните плурипотентни стволови клетки (iPSCs), няколко предизвикателства и ограничения остават. Една основна загриженост е страничните ефекти, при които системата CRISPR-Cas9 може случайно да се свърже и модифицира нежелани геномни локуси, което потенциално води до непредсказуеми епигенетични промени и геномна нестабилност. Това е особено критично в контекста на подмладяването на iPSC, тъй като дори и малки странични модификации могат да компрометират плурипотентността или да активират онкогенни пътища Nature Reviews Genetics.
Друго ограничение е ефективността и специфичността на епигенетичното редактиране. Докато катализаторно мъртъв Cas9 (dCas9), свързан с епигенетични модификатори, може да насочва специфични локуси, степента и устойчивостта на епигенетичните промени — като метилиране на ДНК или модификация на хистони — често са променливи и може да не възстановят напълно младежкия епигенетичен ландшафт, необходим за здраво подмладяване на iPSC Cell Stem Cell. Освен това, доставката на компоненти CRISPR-dCas9 в iPSCs остава технически предизвикателна, като вирусните вектори представляват рискове от инсерционна мутагенеза, а не-вирусните методи често страдат от ниска ефективност.
Имуногенността е друга загриженост, тъй като въвеждането на екзогенни протеини, като Cas9, може да предизвика имунни реакции, особено в клинични приложения. Освен това, дългосрочната стабилност и безопасност на епигенетично модифицираните iPSCs все още не са напълно установени, което повдига въпроси относно тяхната пригодност за терапевтична употреба U.S. Food & Drug Administration. Решаването на тези предизвикателства е от съществено значение за безопасната и ефективна транслация на стратегиите за епигенетична модификация с CRISPR-Cas9 в подмладяването на iPSC.
Терапевтични импликации и приложения в регенеративната медицина
Приложението на епигенетичната модификация, базирана на CRISPR-Cas9, в подмладяването на индуцирани плурипотентни стволови клетки (iPSC), носи значителни обещания за терапевтични интервенции и регенеративна медицина. Чрез прецизно насочване и модифициране на епигенетични маркери — като метилиране на ДНК и модификации на хистони — в специфични геномни локуси, изследователите могат да обърнат свързаните с възрастта епигенетични промени в iPSCs, като по този начин увеличават тяхната плурипотентност, геномна стабилност и потенциал за диференциране. Този процес на подмладяване е критичен за генерирането на висококачествени iPSCs, подходящи за терапии с клетъчна замяна, моделиране на заболявания и скрининг на лекарства.
В регенеративната медицина, подмладените iPSCs могат да бъдат диференцирани в различни клетъчни типове с подобрена функционалност и намален риск от сенесценция или туморогенност, което адресира основни проблеми за безопасността в клиничните приложения. Например, епигенетичното редактиране на гени, свързани с клетъчното стареене, като p16INK4a или TERT, може да възстанови младежките профили на генната експресия и дължината на теломерите, увеличавайки терапевтичната ефективност на произведените клетки. Освен това, протеините на dCas9, свързани с епигенетични модификатори, позволяват обратимо и локус-специфично модифициране, минимизирайки страничните ефекти и постоянните геномни изменения, което е от съществено значение за клиничната транслация Nature Reviews Genetics.
Възможността за подмладяване на iPSCs, получени от пациенти, също отваря пътища за персонализирани регенеративни терапии, при които автоложните клетки могат да бъдат подмладени, коригирани за мутации, причиняващи заболявания, и диференцирани в функционални тъкани за трансплантация. Този подход има потенциала да лекува широк спектър от дегенеративни заболявания, включително невродегенеративни разстройства, сърдечно-съдови заболявания и диабет, като предоставя възобновяем източник на младежки, специфични за пациента клетки Cell Stem Cell. С развитието на технологията, интегрирането на епигенетичната модификация с CRISPR-Cas9 с терапиите, базирани на iPSC, може да революционизира ландшафта на регенеративната медицина.
Етични съображения и регулаторен ландшафт
Приложението на епигенетичната модификация, медиирана от CRISPR-Cas9, в подмладяването на индуцирани плурипотентни стволови клетки (iPSC) поставя значителни етични и регулаторни предизвикателства. За разлика от традиционното редактиране на гени, епигенетичната модификация не променя последователността на ДНК, а вместо това модифицира генната експресия чрез обратими промени, като метилиране на ДНК или модификация на хистони. Въпреки че това може да намали някои от опасенията, свързани с постоянни генетични изменения, дългосрочните ефекти и потенциалът за странични въздействия остават несигурни, повдигайки въпроси относно безопасността и непредвидените последици в клиничните приложения.
Етично, използването на CRISPR-Cas9 в подмладяването на iPSC се пресича с дебати относно човешкото подобряване, съгласие и потенциала за предаване на генетични изменения, ако подмладените клетки се използват в репродуктивни контексти. Съществува и загриженост относно равнопоставен достъп до такива напреднали терапии, което може да влоши съществуващите здравни неравенства. Възможността за създаване на „дизайнерски“ клетки или тъкани допълнително усложнява етичния ландшафт, което налага стабилен надзор и обществено участие.
Регулаторните рамки за интервенции, базирани на CRISPR, все още се развиват. В Съединените щати, Управлението по храните и лекарствата (U.S. Food and Drug Administration) наблюдава генната терапия и клетъчните продукти, но конкретни насоки за епигенетично редактиране са в процес на разработка. Европейската агенция по лекарствата също регулира продуктите за напреднали терапевтични лекарства, включително тези, свързани с редактиране на генома и епигенома. На международно ниво, организации като Световната здравна организация призовават за глобални стандарти и управление, за да се справят с уникалните рискове и етични дилеми, породени от тези технологии.
С напредването на изследванията, продължаващият диалог между учени, етици, регулатори и обществото ще бъде от съществено значение за осигуряване на отговорна иновация и безопасно, равно разпространение на епигенетичната модификация с CRISPR-Cas9 в подмладяването на iPSC.
Бъдещи насоки: Възникващи технологии и изследователски фронтове
Бъдещето на епигенетичната модификация с CRISPR-Cas9 в подмладяването на индуцирани плурипотентни стволови клетки (iPSC) е готово за значителни напредъци, движени от възникващи технологии и нови изследователски фронтове. Една обещаваща посока е интеграцията на епигенетичното редактиране, базирано на CRISPR, с многомолекулярни анализи на единични клетки, позволяваща прецизно картографиране и манипулиране на състоянията на хроматина, метилирането на ДНК и модификациите на хистони на индивидуално клетъчно ниво. Този подход може да разкрие хетерогенността на популациите на iPSC и да оптимизира протоколите за подмладяване за подобрена клетъчна функция и дълголетие Nature Reviews Genetics.
Друг фронт включва разработването на следващото поколение системи CRISPR, като базови редактори и главни редактори, които позволяват по-фини и обратими епигенетични модификации без въвеждане на двуверижни разкъсвания. Тези инструменти могат да минимизират страничните ефекти и геномната нестабилност, адресирайки основни проблеми за безопасността в клиничните приложения Cell Stem Cell. Освен това, използването на програмируеми епигенетични ефектори, като dCas9, свързан с ензими, модифициращи хроматина, се изследва за нулиране на свързаните с възрастта епигенетични маркери и възстановяване на младежките профили на генната експресия в iPSCs Science.
Гледайки напред, сблъсъкът на изкуствения интелект и машинното обучение с технологиите CRISPR се очаква да ускори идентифицирането на цели за подмладяване и да предскаже оптимални стратегии за редактиране. Освен това, напредъците в системите за доставка, като методи, базирани на наночастици или без вируси, ще увеличат ефективността и безопасността на епигенетичното редактиране в iPSCs. В съвкупност, тези иновации носят потенциала да революционизират регенеративната медицина и моделирането на заболявания, свързани с възрастта, като позволят прецизно, безопасно и дълготрайно подмладяване на iPSC Nature Biotechnology.
Заключение: Пътят напред за подмладяване на iPSC чрез CRISPR-Cas9
Приложението на епигенетичната модификация, медиирана от CRISPR-Cas9, в подмладяването на индуцирани плурипотентни стволови клетки (iPSCs) представлява трансформиращ фронт в регенеративната медицина. Чрез възможността за прецизно, локус-специфично редактиране на епигенетични маркери, тази технология предлага потенциала да нулира свързаните с възрастта молекулярни подписи, да подобри качеството на iPSC и да увеличи тяхната терапевтична полезност. Наскоро постигнатите напредъци демонстрират осъществимостта на целенасочването на ключови епигенетични регулатори за възстановяване на младежките профили на генната експресия и функционалните способности в iPSCs, като по този начин адресират ограничения като остатъчната епигенетична памет и непълното пренастройване Nature Reviews Genetics.
Гледайки напред, няколко предизвикателства и възможности определят пътя към клиничната транслация. Осигуряването на специфичността и безопасността на епигенетичното редактиране, базирано на CRISPR, остава от първостепенно значение, тъй като страничните ефекти и непредвидените хроматинови изменения могат да компрометират клетъчната функция или безопасността U.S. Food & Drug Administration. Развитието на инструменти от следващо поколение CRISPR с подобрена прецизност, както и надеждни системи за доставка, ще бъде критично за напредъка в тази област. Освен това, интегрирането на многомолекулярни подходи за мониторинг и валидиране на резултатите от подмладяване ще подобри нашето разбиране за основните механизми и ще улесни регулаторното одобрение National Human Genome Research Institute.
В крайна сметка, сблъсъкът на технологията CRISPR-Cas9 и биологията на iPSC носи огромни обещания за персонализирани клетъчни терапии, моделиране на заболявания и изучаване на човешкото стареене. Продължаващото междудисциплинарно сътрудничество и етичен надзор ще бъдат от съществено значение за реализирането на пълния терапевтичен потенциал на подмладяването на iPSC чрез епигенетична модификация.