Jak epigenetická modulace CRISPR-Cas9 revolucionalizuje omlazení indukovaných pluripotentních kmenových buněk (iPSC) — Hloubkový pohled na vědu a budoucí potenciál
- Úvod do omlazení iPSC a epigenetické modulace
- CRISPR-Cas9: Mechanismy a inovace v epigenetickém editaci
- Klíčové epigenetické cíle pro omlazení iPSC
- Nedávné pokroky: Případové studie a experimentální výsledky
- Výzvy a omezení v epigenetické modulaci CRISPR-Cas9
- Terapeutické implikace a aplikace regenerativní medicíny
- Etické úvahy a regulační rámec
- Budoucí směry: Nové technologie a výzkumné hranice
- Závěr: Cesta vpřed pro omlazení iPSC pomocí CRISPR-Cas9
- Zdroje & Odkazy
Úvod do omlazení iPSC a epigenetické modulace
Indukované pluripotentní kmenové buňky (iPSCs) jsou somatické buňky přeprogramované do pluripotentního stavu, což jim umožňuje diferencovat se do různých typů buněk a nabízet obrovský potenciál pro regenerativní medicínu a modelování nemocí. Nicméně, iPSCs často zachovávají zbytkovou epigenetickou paměť ze svých původních buněk, což může omezit jejich plný potenciál omlazení a diferenciace. Epigenetická modulace — změna chemických modifikací na DNA nebo histonech bez změny základního genetického kódu — se ukázala jako slibná strategie pro zlepšení omlazení iPSC resetováním těchto epigenetických znaků do embryonálně podobného stavu.
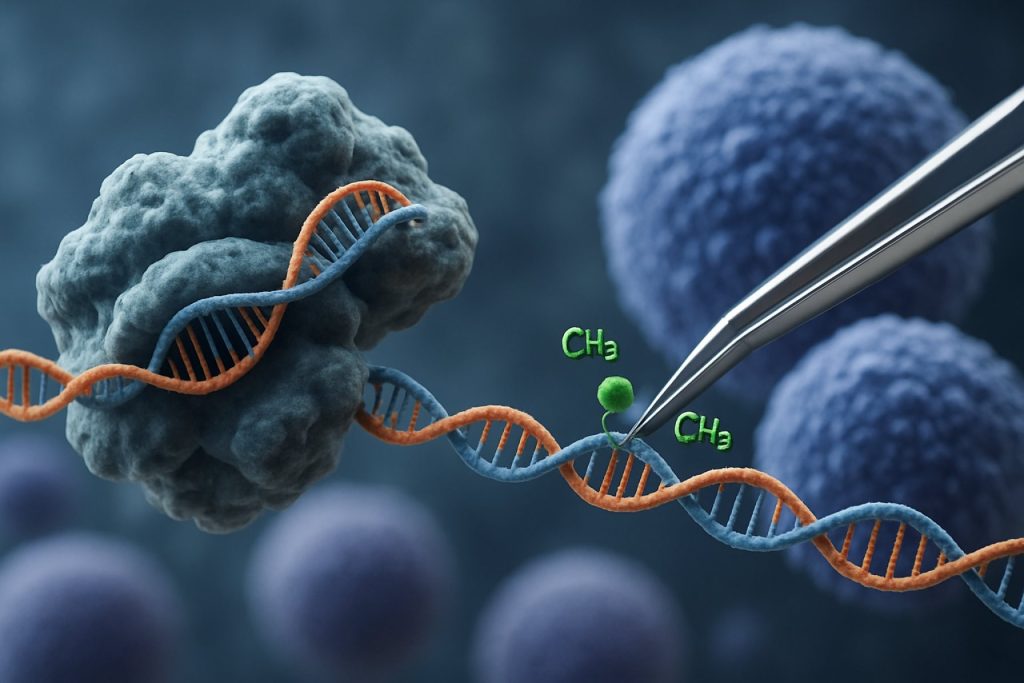
Příchod technologie CRISPR-Cas9 revolucionalizoval oblast epigenetického editace. Na rozdíl od tradičních aplikací CRISPR, které vyvolávají dvojitá přerušení pro editaci genů, epigenetická modulace založená na CRISPR používá katalyticky neaktivní Cas9 (dCas9) spojený s epigenetickými efektorovými doménami. Tento systém umožňuje přesnou, lokus-specifickou modifikaci epigenetických znaků, jako je methylace DNA nebo acetylace histonů, čímž umožňuje cílené přeprogramování profilů genové exprese v iPSCs. Takové cílené intervence mohou vymazat epigenetické podpisy spojené s věkem nebo specifické pro linii, což podporuje úplnější omlazení iPSCs a zlepšuje jejich funkční vlastnosti.
Nedávné studie prokázaly proveditelnost použití systémů CRISPR-dCas9 k modulaci klíčových genů spojených s omlazením a epigenetických regulátorů v iPSCs, což otevírá cestu pro efektivnější a bezpečnější terapie kmenovými buňkami. Jak se obor vyvíjí, integrace epigenetické modulace CRISPR-Cas9 s technologií iPSC nese značný potenciál pro překonání současných omezení v buněčném přeprogramování a pro vývoj personalizovaných přístupů v regenerativní medicíně (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9: Mechanismy a inovace v epigenetickém editaci
Systém CRISPR-Cas9, původně vyvinutý pro přesné editace genomu, byl inovativně přizpůsoben pro cílenou epigenetickou modulaci, což nabízí nové cesty pro omlazení indukovaných pluripotentních kmenových buněk (iPSCs). Na rozdíl od tradičního CRISPR-Cas9, které zavádí dvojitá přerušení pro editaci sekvencí DNA, epigenetická editace využívá katalyticky neaktivní Cas9 (dCas9) spojený s epigenetickými efektorovými doménami. To umožňuje lokus-specifickou modifikaci stavů chromatinu — jako je methylace DNA nebo acetylace histonů — aniž by došlo ke změně základního genetického kódu. Taková přesnost je klíčová pro omlazení iPSC, kde resetování epigenetické krajiny může obnovit mladistvé profily genové exprese a zlepšit buněčnou funkci.
Mezi nedávné inovace patří dCas9 spojený s DNA methyltransferázami nebo demethylázami, stejně jako histonovými acetyltransferázami nebo deacetylázami, což umožňuje reverzibilní aktivaci nebo represii cílových genů zapojených do stárnutí a senescence. Například cílená demethylace promotorů genů pro pluripotenci může znovu aktivovat jejich exprese, čímž zlepšuje kvalitu iPSC a potenciál diferenciace. Dále byla prokázána multiplexní epigenetická editace — současné cílení na více lokusů — což dále zlepšuje proces omlazení orchestrací složitých genových regulačních sítí Nature Reviews Genetics.
Tyto pokroky jsou doplněny zlepšenými dodávkovými systémy, jako jsou ribonukleoproteinové komplexy a virové vektory, které zvyšují efektivitu editace a snižují off-target efekty. Celkově představuje epigenetická editace založená na CRISPR-Cas9 transformativní přístup k omlazení iPSC, s potenciálem překonat omezení konvenčního přeprogramování a otevřít cestu pro regenerativní terapie Cell Stem Cell.
Klíčové epigenetické cíle pro omlazení iPSC
Kritickým aspektem využití CRISPR-Cas9 pro epigenetickou modulaci při omlazení indukovaných pluripotentních kmenových buněk (iPSC) je identifikace a cílení klíčových epigenetických regulátorů, které řídí buněčné stárnutí a pluripotenci. Mezi nejvýznamnější cíle patří vzory methylace DNA, modifikace histonů a lokusy nekódujících RNA, které hrají zásadní roli při udržování nebo vymazávání buněčné paměti během přeprogramování. Například stav methylace promotoru p16INK4a, známého markera senescence, prokázal vliv na proliferativní kapacitu a potenciál omlazení iPSC. Systémy CRISPR-dCas9 spojené s DNA demethylázami nebo methyltransferázami mohou být přesně směrovány na takové lokusy, aby modulovaly jejich epigenetický stav, čímž zvyšují efektivitu přeprogramování a buněčnou mladistvost Nature Reviews Genetics.
Dalším klíčovým cílem je regulace modifikací histonů, jako jsou H3K9me3 a H3K27me3, které jsou spojeny s tvorbou heterochromatinu a ztišením genů. Cílená editace těchto znaků v konkrétních genomových oblastech pomocí CRISPR-dCas9 spojeného s enzymy modifikujícími histony může znovu aktivovat geny pro pluripotenci nebo potlačit geny spojené se stárnutím, což usnadňuje robustnější proces omlazení Cell Stem Cell. Dále se dlouhé nekódující RNA (lncRNA), které modulují architekturu chromatinu a genovou expresi, stávají slibnými cíli CRISPR pro jemné doladění epigenetické krajiny iPSC Nature Cell Biology.
Celkově strategický výběr a přesná modulace těchto epigenetických cílů pomocí nástrojů založených na CRISPR-Cas9 nesou značný potenciál pro pokrok v omlazení iPSC a vývoj regenerativních terapií.
Nedávné pokroky: Případové studie a experimentální výsledky
V posledních letech došlo k významnému pokroku ve využívání epigenetické modulace založené na CRISPR-Cas9 k omlazení indukovaných pluripotentních kmenových buněk (iPSCs). Zejména několik studií prokázalo proveditelnost použití katalyticky neaktivního Cas9 (dCas9) spojeného s epigenetickými modifikátory k cílení a remodelování specifických oblastí chromatinu, čímž se obracejí epigenetické znaky spojené s věkem v iPSCs. Například průlomová studie publikovaná v Nature uvedla použití dCas9-TET1 k demethylaci promotorových oblastí klíčových genů pro pluripotenci, což vedlo k zvýšené efektivitě přeprogramování a zlepšeným markerům omlazení buněk.
Další zásadní experiment publikovaný v Cell Stem Cell využil dCas9-p300 k acetylaci histonu H3K27 v lokusech spojených s mladistvými profily genové exprese. Tato cílená epigenetická editace nejen obnovila mladistvé transkripční signatury, ale také zlepšila mitochondriální funkci a snížila fenotypy spojené se senescencí v iPSCs od starších dárců.
Dále nedávná preklinická studie publikovaná v Science prokázala, že multiplexní epigenetická editace CRISPR-dCas9 může současně modulovat více cest souvisejících se stárnutím, což vede k synergickým efektům na omlazení iPSC. Tyto nálezy kolektivně zdůrazňují potenciál epigenetické modulace CRISPR-Cas9 jako přesného a univerzálního nástroje pro obrácení buněčného stárnutí v iPSCs, čímž otevírají cestu pro budoucí translationalní aplikace v regenerativní medicíně a modelování nemocí souvisejících se stárnutím.
Výzvy a omezení v epigenetické modulaci CRISPR-Cas9
Navzdory transformačnímu potenciálu epigenetické modulace založené na CRISPR-Cas9 při omlazení indukovaných pluripotentních kmenových buněk (iPSCs) přetrvávají některé výzvy a omezení. Jednou z hlavních obav jsou off-target efekty, kdy systém CRISPR-Cas9 může neúmyslně vázat a modifikovat neúmyslné genomové lokusy, což může vést k nepředvídatelným epigenetickým změnám a genomové instabilitě. To je obzvlášť kritické v kontextu omlazení iPSC, protože i drobné off-target modifikace mohou ohrozit pluripotenci nebo vyvolat onkogenní dráhy Nature Reviews Genetics.
Další omezení spočívá v efektivitě a specificitě epigenetické editace. I když může být katalyticky neaktivní Cas9 (dCas9) spojený s epigenetickými modifikátory zaměřen na specifické lokusy, míra a přetrvání epigenetických změn — jako je methylace DNA nebo modifikace histonů — jsou často proměnlivé a nemusí plně rekapitulovat mladistvou epigenetickou krajinu potřebnou pro robustní omlazení iPSC Cell Stem Cell. Dále zůstává dodávka komponent CRISPR-dCas9 do iPSCs technicky náročná, přičemž virové vektory představují rizika inzertní mutageneze a nevirové metody často trpí nízkou efektivitou.
Imunogenicita je další obava, protože zavedení exogenních proteinů, jako je Cas9, může vyvolat imunitní odpovědi, zejména v klinických aplikacích. Kromě toho dlouhodobá stabilita a bezpečnost epigeneticky modifikovaných iPSCs dosud nebyla plně prokázána, což vyvolává otázky o jejich vhodnosti pro terapeutické použití U.S. Food & Drug Administration. Řešení těchto výzev je nezbytné pro bezpečnou a efektivní translaci strategií epigenetické modulace CRISPR-Cas9 v omlazení iPSC.
Terapeutické implikace a aplikace regenerativní medicíny
Aplikace epigenetické modulace založené na CRISPR-Cas9 v omlazení indukovaných pluripotentních kmenových buněk (iPSC) nese značný potenciál pro terapeutické intervence a regenerativní medicínu. Cílením a modifikací epigenetických znaků — jako je methylace DNA a modifikace histonů — na specifických genomových lokusech mohou výzkumníci obracet epigenetické změny spojené s věkem v iPSCs, čímž zvyšují jejich pluripotenci, genomovou stabilitu a potenciál diferenciace. Tento proces omlazení je klíčový pro generování vysoce kvalitních iPSCs vhodných pro terapie nahrazující buňky, modelování nemocí a screening léků.
V regenerativní medicíně mohou omlazené iPSCs být diferencovány do různých typů buněk s lepší funkčností a sníženým rizikem senescence nebo tumorigenicity, což řeší hlavní bezpečnostní obavy v klinických aplikacích. Například epigenetická editace genů zapojených do buněčného stárnutí, jako je p16INK4a nebo TERT, může obnovit mladistvé profily genové exprese a délku telomer, což zvyšuje terapeutickou účinnost odvozených buněk. Navíc, fúzní proteiny CRISPR-dCas9 vázané na epigenetické modifikátory umožňují reverzibilní a lokus-specifickou modulaci, čímž minimalizují off-target efekty a trvalé genomové změny, což je klíčové pro klinickou translaci Nature Reviews Genetics.
Schopnost omladit iPSCs odvozené od pacientů také otevírá cesty pro personalizované regenerativní terapie, kde mohou být autologní buňky omlazeny, opraveny na mutace způsobující nemoc a diferencovány do funkčních tkání pro transplantaci. Tento přístup má potenciál léčit širokou škálu degenerativních onemocnění, včetně neurodegenerativních poruch, kardiovaskulárních onemocnění a diabetu, tím, že poskytuje obnovitelný zdroj mladistvých, pacient-specifických buněk Cell Stem Cell. Jak se technologie vyvíjí, integrace epigenetické modulace CRISPR-Cas9 s terapiemi založenými na iPSC by mohla revolucionalizovat krajinu regenerativní medicíny.
Etické úvahy a regulační rámec
Aplikace epigenetické modulace zprostředkované CRISPR-Cas9 v omlazení indukovaných pluripotentních kmenových buněk (iPSC) představuje významné etické a regulační výzvy. Na rozdíl od tradiční editace genů, epigenetická modulace nemění sekvenci DNA, ale místo toho modifikuje genovou expresi prostřednictvím reverzibilních změn, jako je methylace DNA nebo modifikace histonů. I když to může snížit některé obavy spojené s trvalými genetickými změnami, dlouhodobé účinky a potenciál off-target dopadů zůstávají nejisté, což vyvolává otázky o bezpečnosti a neúmyslných důsledcích v klinických aplikacích.
Eticky se využití CRISPR-Cas9 v omlazení iPSC kříží s debatami o lidském vylepšení, souhlasu a potenciálu germinálního přenosu, pokud jsou omlazené buňky použity v reprodukčních kontextech. Existují také obavy o spravedlivý přístup k takovým pokročilým terapiím, což by mohlo zhoršit existující zdravotní nerovnosti. Možnost vytváření „designových“ buněk nebo tkání dále komplikuje etickou krajinu, což vyžaduje robustní dohled a zapojení veřejnosti.
Regulační rámce pro intervence založené na CRISPR se stále vyvíjejí. Ve Spojených státech dohlíží U.S. Food and Drug Administration na genovou terapii a produkty na bázi buněk, ale konkrétní pokyny pro epigenetické editace jsou ve vývoji. Evropská léková agentura podobně reguluje pokročilé terapeutické léčivé přípravky, včetně těch, které zahrnují editaci genomu a epigenomu. Na mezinárodní úrovni organizace jako Světová zdravotnická organizace vyzvaly k globálním standardům a správě, aby se vyrovnaly s jedinečnými riziky a etickými dilematy, které tyto technologie představují.
Jak výzkum postupuje, bude nezbytný průběžný dialog mezi vědci, etikou, regulátory a veřejností, aby se zajistila odpovědná inovace a bezpečné, spravedlivé nasazení epigenetické modulace CRISPR-Cas9 v omlazení iPSC.
Budoucí směry: Nové technologie a výzkumné hranice
Budoucnost epigenetické modulace CRISPR-Cas9 v omlazení indukovaných pluripotentních kmenových buněk (iPSC) je připravena na významné pokroky, poháněné novými technologiemi a novými výzkumnými hranicemi. Jedním z slibných směrů je integrace epigenetického editování založeného na CRISPR s multi-omickým přístupem na úrovni jednotlivých buněk, což umožňuje přesné mapování a manipulaci stavů chromatinu, methylace DNA a modifikací histonů na úrovni jednotlivých buněk. Tento přístup by mohl odhalit heterogenitu populací iPSC a optimalizovat protokoly omlazení pro zlepšenou buněčnou funkci a dlouhověkost Nature Reviews Genetics.
Další hranicí je vývoj systémů CRISPR nové generace, jako jsou bazové editory a primární editory, které umožňují jemnější a reverzibilní epigenetické modifikace bez zavádění dvojitých přerušení. Tyto nástroje mohou minimalizovat off-target efekty a genomovou instabilitu, což řeší klíčové bezpečnostní obavy v klinických aplikacích Cell Stem Cell. Kromě toho se zkoumá použití programovatelných epigenetických efektorů, jako je dCas9 spojený s enzymy modifikujícími chromatin, k resetování epigenetických znaků spojených se stárnutím a obnově mladistvých profilů genové exprese v iPSCs Science.
S výhledem do budoucna se očekává, že konvergence umělé inteligence a strojového učení s technologiemi CRISPR urychlí identifikaci cílů omlazení a předpoví optimální strategie editace. Dále pokroky v dodávkových systémech, jako jsou nanopartikulové nebo metody bez virů, zvýší efektivitu a bezpečnost epigenetického editování v iPSCs. Tyto inovace mají potenciál revolucionalizovat regenerativní medicínu a modelování nemocí souvisejících se stárnutím tím, že umožní přesné, bezpečné a trvalé omlazení iPSC Nature Biotechnology.
Závěr: Cesta vpřed pro omlazení iPSC pomocí CRISPR-Cas9
Aplikace epigenetické modulace zprostředkované CRISPR-Cas9 při omlazení indukovaných pluripotentních kmenových buněk (iPSCs) představuje transformační hranici v regenerativní medicíně. Umožněním přesného, lokus-specifického editování epigenetických znaků tato technologie nabízí potenciál resetovat molekulární podpisy spojené se stárnutím, zlepšit kvalitu iPSC a zvýšit jejich terapeutickou užitečnost. Nedávné pokroky prokázaly proveditelnost cílení na klíčové epigenetické regulátory za účelem obnovení mladistvých profilů genové exprese a funkčních schopností v iPSCs, čímž se řeší omezení, jako je zbytková epigenetická paměť a neúplné přeprogramování Nature Reviews Genetics.
S výhledem do budoucna definují několik výzev a příležitostí cestu k klinické translaci. Zajištění specificity a bezpečnosti epigenetického editování založeného na CRISPR zůstává zásadní, protože off-target efekty a neúmyslné změny chromatinu by mohly ohrozit funkci buněk nebo bezpečnost U.S. Food & Drug Administration. Vývoj nástrojů CRISPR nové generace s vylepšenou věrností, stejně jako robustní dodávkové systémy, bude klíčový pro pokrok v této oblasti. Dále integrace multi-omických přístupů k monitorování a validaci výsledků omlazení zvýší naše porozumění základním mechanismům a usnadní regulační schválení National Human Genome Research Institute.
Nakonec konvergence technologie CRISPR-Cas9 a biologie iPSC nese obrovský potenciál pro personalizované buněčné terapie, modelování nemocí a studium lidského stárnutí. Pokračující interdisciplinární spolupráce a etický dohled budou nezbytné pro realizaci plného terapeutického potenciálu omlazení iPSC prostřednictvím epigenetické modulace.