Wie die CRISPR-Cas9-Epigenetische Modulation die Verjüngung induzierter pluripotenter Stammzellen (iPSCs) revolutioniert – Ein tiefer Einblick in die Wissenschaft und das zukünftige Potenzial
- Einführung in die iPSC-Verjüngung und epigenetische Modulation
- CRISPR-Cas9: Mechanismen und Innovationen in der epigenetischen Bearbeitung
- Wichtige epigenetische Ziele für die iPSC-Verjüngung
- Aktuelle Fortschritte: Fallstudien und experimentelle Ergebnisse
- Herausforderungen und Einschränkungen der CRISPR-Cas9-Epigenetischen Modulation
- Therapeutische Implikationen und Anwendungen der regenerativen Medizin
- Ethische Überlegungen und regulatorische Landschaft
- Zukünftige Richtungen: Aufkommende Technologien und Forschungsgrenzen
- Fazit: Der Weg zur iPSC-Verjüngung über CRISPR-Cas9
- Quellen & Referenzen
Einführung in die iPSC-Verjüngung und epigenetische Modulation
Induzierte pluripotente Stammzellen (iPSCs) sind somatische Zellen, die in einen pluripotenten Zustand umprogrammiert wurden, wodurch sie sich in verschiedene Zelltypen differenzieren können und enormes Potenzial für regenerative Medizin und Krankheitsmodellierung bieten. Allerdings behalten iPSCs oft eine restliche epigenetische Erinnerung an ihre Ursprungszellen, was ihr vollständiges Verjüngungs- und Differenzierungspotenzial einschränken kann. Die epigenetische Modulation – die chemischen Modifikationen an DNA oder Histonen ändert, ohne den zugrunde liegenden genetischen Code zu verändern – hat sich als vielversprechende Strategie herausgestellt, um die Verjüngung von iPSCs zu verbessern, indem diese epigenetischen Marker auf einen embryonalen Zustand zurückgesetzt werden.
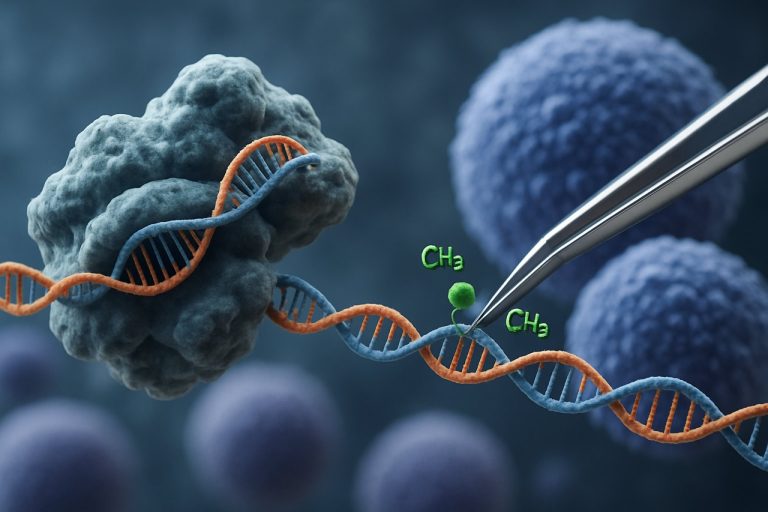
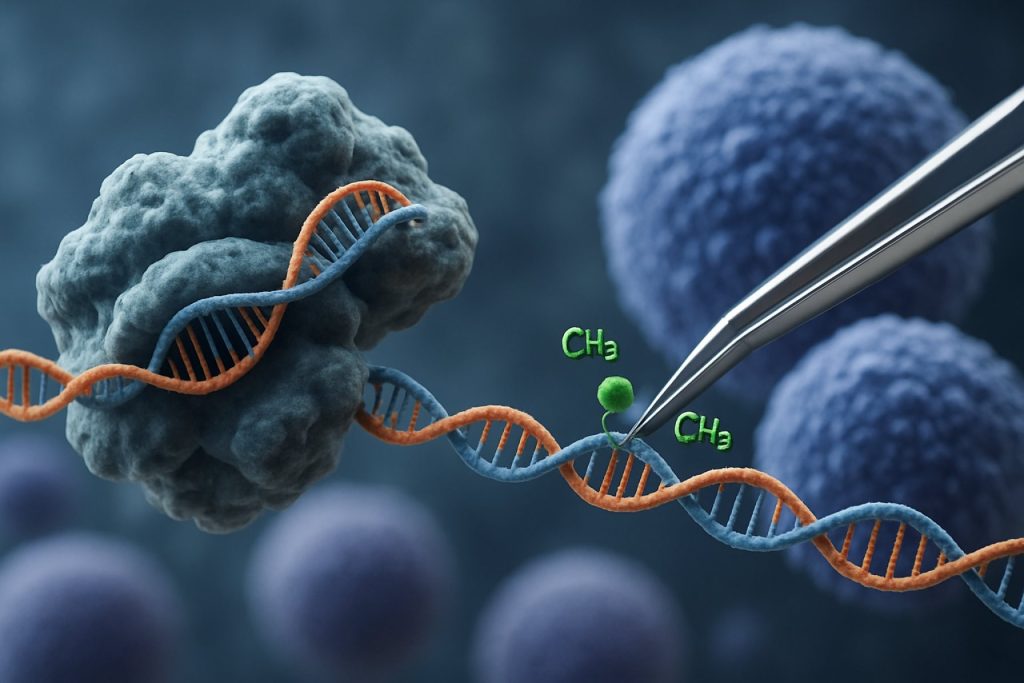
Die Einführung der CRISPR-Cas9-Technologie hat das Feld der epigenetischen Bearbeitung revolutioniert. Im Gegensatz zu traditionellen CRISPR-Anwendungen, die Doppelstrangbrüche zur Genbearbeitung induzieren, verwendet die CRISPR-basierte epigenetische Modulation katalytisch inaktive Cas9 (dCas9), die mit epigenetischen Effektor-Domänen fusioniert ist. Dieses System ermöglicht eine präzise, locus-spezifische Modifikation von epigenetischen Markierungen, wie z.B. DNA-Methylierung oder Histon-Acetylierung, wodurch eine gezielte Umprogrammierung von Genexpressionsprofilen in iPSCs ermöglicht wird. Solche gezielten Interventionen können altersassoziierte oder linien-spezifische epigenetische Signaturen auslöschen, was eine vollständigere Verjüngung von iPSCs fördert und ihre funktionalen Eigenschaften verbessert.
Jüngste Studien haben die Machbarkeit der Verwendung von CRISPR-dCas9-Systemen zur Modulation von Schlüsselgenen und epigenetischen Regulatoren, die mit der Verjüngung assoziiert sind, in iPSCs demonstriert und den Weg für effizientere und sicherere Stammzelltherapien geebnet. Mit dem Fortschritt des Feldes hält die Integration von CRISPR-Cas9-epigenetischer Modulation mit iPSC-Technologie großes Versprechen für die Überwindung der aktuellen Einschränkungen in der zellulären Umprogrammierung und für die Entwicklung personalisierter regenerativer Medizinansätze (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9: Mechanismen und Innovationen in der epigenetischen Bearbeitung
Das CRISPR-Cas9-System, das ursprünglich für präzise Genom-Bearbeitung entwickelt wurde, wurde innovativ für gezielte epigenetische Modulation angepasst und bietet neue Wege für die Verjüngung induzierter pluripotenter Stammzellen (iPSCs). Im Gegensatz zu traditionellem CRISPR-Cas9, das Doppelstrangbrüche einführt, um DNA-Sequenzen zu bearbeiten, verwendet die epigenetische Bearbeitung eine katalytisch inaktive Cas9 (dCas9), die mit epigenetischen Effektor-Domänen fusioniert ist. Dies ermöglicht eine locus-spezifische Modifikation von Chromatinzuständen – wie DNA-Methylierung oder Histon-Acetylierung – ohne den zugrunde liegenden genetischen Code zu verändern. Eine solche Präzision ist entscheidend für die iPSC-Verjüngung, bei der das Zurücksetzen der epigenetischen Landschaft die jugendlichen Genexpressionsprofile wiederherstellen und die zelluläre Funktion verbessern kann.
Zu den jüngsten Innovationen gehören dCas9, das mit DNA-Methyltransferasen oder Demethylasen sowie mit Histon-Acetyltransferasen oder Deacetylasen fusioniert ist, was die reversible Aktivierung oder Repression von Zielgenen ermöglicht, die mit Alterung und Seneszenz assoziiert sind. Zum Beispiel kann die gezielte Demethylierung von Promotoren für Pluripotenzgene deren Expression reaktivieren und die Qualität und das Differenzierungspotenzial von iPSCs verbessern. Darüber hinaus wurde eine multiplexe epigenetische Bearbeitung – die gleichzeitige Zielung mehrerer Loci – demonstriert, was den Verjüngungsprozess weiter verbessert, indem komplexe genregulatorische Netzwerke orchestriert werden Nature Reviews Genetics.
Diese Fortschritte werden durch verbesserte Liefersysteme ergänzt, wie z.B. Ribonukleoprotein-Komplexe und virale Vektoren, die die Bearbeitungseffizienz erhöhen und Off-Target-Effekte reduzieren. Insgesamt stellt die CRISPR-Cas9-basierte epigenetische Bearbeitung einen transformativen Ansatz für die iPSC-Verjüngung dar, mit dem Potenzial, die Einschränkungen der herkömmlichen Umprogrammierung zu überwinden und den Weg für regenerative Therapien zu ebnen Cell Stem Cell.
Wichtige epigenetische Ziele für die iPSC-Verjüngung
Ein kritischer Aspekt der Nutzung von CRISPR-Cas9 für die epigenetische Modulation in der Verjüngung induzierter pluripotenter Stammzellen (iPSCs) ist die Identifizierung und Zielsetzung von Schlüsselregulatoren, die das zelluläre Altern und die Pluripotenz steuern. Zu den prominentesten Zielen gehören DNA-Methylierungsmuster, Histonmodifikationen und nicht-kodierende RNA-Loci, die alle entscheidende Rollen bei der Aufrechterhaltung oder dem Löschen von zellulärer Erinnerung während der Umprogrammierung spielen. Beispielsweise hat der Methylierungsstatus des p16INK4a-Promotors, eines bekannten Seneszenzmarkes, gezeigt, dass er die proliferative Kapazität und das Verjüngungspotenzial von iPSCs beeinflusst. CRISPR-dCas9-Systeme, die mit DNA-Demethylasen oder Methyltransferasen fusioniert sind, können gezielt auf solche Loci gerichtet werden, um ihren epigenetischen Zustand zu modulieren und so die Umprogrammierungseffizienz und die zelluläre Jugendlichkeit zu erhöhen Nature Reviews Genetics.
Ein weiteres wichtiges Ziel ist die Regulierung von Histonmodifikationen, wie H3K9me3 und H3K27me3, die mit der Heterochromatinbildung und der Genstilllegung assoziiert sind. Die gezielte Bearbeitung dieser Markierungen an spezifischen genomischen Regionen unter Verwendung von CRISPR-dCas9, das mit histonmodifizierenden Enzymen fusioniert ist, kann Pluripotenzgene reaktivieren oder alterungsassoziierte Gene unterdrücken, was einen robusteren Verjüngungsprozess erleichtert Cell Stem Cell. Darüber hinaus sind lange nicht-kodierende RNAs (lncRNAs), die die Chromatinarchitektur und die Genexpression modulieren, aufkommende vielversprechende CRISPR-Ziele zur Feinabstimmung der epigenetischen Landschaft von iPSCs Nature Cell Biology.
Insgesamt verspricht die strategische Auswahl und präzise Modulation dieser epigenetischen Ziele unter Verwendung von CRISPR-Cas9-basierten Werkzeugen erhebliche Fortschritte bei der iPSC-Verjüngung und der Entwicklung regenerativer Therapien.
Aktuelle Fortschritte: Fallstudien und experimentelle Ergebnisse
In den letzten Jahren gab es bedeutende Fortschritte bei der Nutzung von CRISPR-Cas9-basierter epigenetischer Modulation zur Verjüngung induzierter pluripotenter Stammzellen (iPSCs). Insbesondere haben mehrere Studien die Machbarkeit demonstriert, katalytisch inaktive Cas9 (dCas9), die mit epigenetischen Modifikatoren fusioniert ist, zu verwenden, um spezifische Chromatinregionen zu zielen und umzugestalten, wodurch altersassoziierte epigenetische Markierungen in iPSCs umgekehrt werden. Zum Beispiel berichtete eine bahnbrechende Studie von Nature über die Verwendung von dCas9-TET1 zur Demethylierung der Promotorregionen von Schlüssel-Pluripotenzgenen, was zu einer erhöhten Umprogrammierungseffizienz und verbesserten Verjüngungsmarkern in iPSCs führte.
Ein weiteres entscheidendes Experiment, das von Cell Stem Cell veröffentlicht wurde, verwendete dCas9-p300, um Histon H3K27 an Loci zu acetylieren, die mit jugendlichen Genexpressionsprofilen assoziiert sind. Diese gezielte epigenetische Bearbeitung stellte nicht nur jugendliche transkriptionale Signaturen wieder her, sondern verbesserte auch die mitochondriale Funktion und reduzierte seneszenzassoziierte Phänotypen in iPSCs, die von älteren Spendern abgeleitet wurden.
Darüber hinaus demonstrierte eine aktuelle präklinische Studie von Science, dass die multiplexe CRISPR-dCas9-epigenetische Bearbeitung gleichzeitig mehrere altersbezogene Signalwege modulieren könnte, was synergistische Effekte auf die iPSC-Verjüngung zur Folge hatte. Diese Ergebnisse unterstreichen insgesamt das Potenzial der CRISPR-Cas9-epigenetischen Modulation als präzises und vielseitiges Werkzeug zur Umkehrung des zellulären Alterns in iPSCs und ebnen den Weg für zukünftige translationalen Anwendungen in der regenerativen Medizin und der Modellierung altersassoziierter Krankheiten.
Herausforderungen und Einschränkungen der CRISPR-Cas9-Epigenetischen Modulation
Trotz des transformativen Potenzials der CRISPR-Cas9-basierten epigenetischen Modulation zur Verjüngung induzierter pluripotenter Stammzellen (iPSCs) bestehen weiterhin mehrere Herausforderungen und Einschränkungen. Eine große Sorge sind Off-Target-Effekte, bei denen das CRISPR-Cas9-System unbeabsichtigt an unbeabsichtigte genomische Loci binden und diese modifizieren kann, was zu unvorhersehbaren epigenetischen Veränderungen und genomischer Instabilität führen kann. Dies ist besonders kritisch im Kontext der iPSC-Verjüngung, da selbst geringfügige Off-Target-Modifikationen die Pluripotenz gefährden oder onkogene Signalwege auslösen können Nature Reviews Genetics.
Eine weitere Einschränkung liegt in der Effizienz und Spezifität der epigenetischen Bearbeitung. Während katalytisch inaktive Cas9 (dCas9), die mit epigenetischen Modifikatoren fusioniert ist, spezifische Loci anvisieren kann, ist das Ausmaß und die Persistenz der epigenetischen Veränderungen – wie DNA-Methylierung oder Histonmodifikation – oft variabel und können möglicherweise nicht die jugendliche epigenetische Landschaft vollständig nachbilden, die für eine robuste iPSC-Verjüngung erforderlich ist Cell Stem Cell. Darüber hinaus bleibt die Lieferung von CRISPR-dCas9-Komponenten in iPSCs technisch herausfordernd, wobei virale Vektoren Risiken für insertionale Mutagenese darstellen und nicht-virale Methoden oft unter geringer Effizienz leiden.
Die Immunogenität ist ein weiteres Anliegen, da die Einführung exogener Proteine wie Cas9 Immunantworten hervorrufen kann, insbesondere in klinischen Anwendungen. Darüber hinaus sind die langfristige Stabilität und Sicherheit von epigenetisch modifizierten iPSCs noch nicht vollständig etabliert, was Fragen zur Eignung für therapeutische Anwendungen aufwirft U.S. Food & Drug Administration. Die Bewältigung dieser Herausforderungen ist entscheidend für die sichere und effektive Übersetzung von CRISPR-Cas9-epigenetischen Modulationsstrategien in der iPSC-Verjüngung.
Therapeutische Implikationen und Anwendungen der regenerativen Medizin
Die Anwendung der CRISPR-Cas9-basierten epigenetischen Modulation in der Verjüngung induzierter pluripotenter Stammzellen (iPSCs) birgt erhebliches Potenzial für therapeutische Interventionen und regenerative Medizin. Durch das präzise Anvisieren und Modifizieren von epigenetischen Markierungen – wie DNA-Methylierung und Histonmodifikationen – an spezifischen genomischen Loci können Forscher altersassoziierte epigenetische Veränderungen in iPSCs umkehren und so ihre Pluripotenz, genomische Stabilität und Differenzierungspotenzial erhöhen. Dieser Verjüngungsprozess ist entscheidend für die Erzeugung hochwertiger iPSCs, die für Zelltransplantationstherapien, Krankheitsmodellierung und Arzneimittel-Screening geeignet sind.
In der regenerativen Medizin können verjüngte iPSCs in verschiedene Zelltypen mit verbesserter Funktionalität und reduziertem Risiko von Seneszenz oder Tumorigenität differenziert werden, was wichtige Sicherheitsbedenken in klinischen Anwendungen anspricht. Zum Beispiel kann die epigenetische Bearbeitung von Genen, die am zellulären Altern beteiligt sind, wie p16INK4a oder TERT, jugendliche Genexpressionsprofile und Telomerlängen wiederherstellen, was die therapeutische Wirksamkeit der abgeleiteten Zellen erhöht. Darüber hinaus ermöglichen CRISPR-dCas9-Fusionsproteine, die an epigenetische Modifikatoren gebunden sind, reversible und locus-spezifische Modulation, wodurch Off-Target-Effekte und permanente genomische Veränderungen minimiert werden, was für die klinische Übersetzung entscheidend ist Nature Reviews Genetics.
Die Fähigkeit, patientenabgeleitete iPSCs zu verjüngen, eröffnet auch Möglichkeiten für personalisierte regenerative Therapien, bei denen autologe Zellen verjüngt, für krankheitsverursachende Mutationen korrigiert und in funktionale Gewebe zur Transplantation differenziert werden können. Dieser Ansatz hat das Potenzial, eine Vielzahl von degenerativen Erkrankungen zu behandeln, einschließlich neurodegenerativer Erkrankungen, Herz-Kreislauf-Erkrankungen und Diabetes, indem er eine erneuerbare Quelle für jugendliche, patientenspezifische Zellen bereitstellt Cell Stem Cell. Mit der Reifung der Technologie könnte die Integration von CRISPR-Cas9-epigenetischer Modulation mit iPSC-basierten Therapien die Landschaft der regenerativen Medizin revolutionieren.
Ethische Überlegungen und regulatorische Landschaft
Die Anwendung der CRISPR-Cas9-vermittelten epigenetischen Modulation in der Verjüngung induzierter pluripotenter Stammzellen (iPSCs) stellt erhebliche ethische und regulatorische Herausforderungen dar. Im Gegensatz zur traditionellen Genbearbeitung verändert die epigenetische Modulation nicht die DNA-Sequenz, sondern modifiziert die Genexpression durch reversible Veränderungen, wie DNA-Methylierung oder Histonmodifikation. Während dies einige Bedenken im Zusammenhang mit permanenten genetischen Veränderungen verringern kann, bleiben die langfristigen Auswirkungen und das Potenzial für Off-Target-Effekte ungewiss, was Fragen zur Sicherheit und unbeabsichtigten Konsequenzen in klinischen Anwendungen aufwirft.
Ethisch überschneidet sich die Verwendung von CRISPR-Cas9 in der iPSC-Verjüngung mit Debatten über menschliche Verbesserung, Einwilligung und das Potenzial für die Keimbahnübertragung, wenn verjüngte Zellen in reproduktiven Kontexten verwendet werden. Es gibt auch Bedenken hinsichtlich des gerechten Zugangs zu solchen fortschrittlichen Therapien, die bestehende Gesundheitsungleichheiten verschärfen könnten. Die Möglichkeit, „Designer“-Zellen oder -Gewebe zu schaffen, kompliziert die ethische Landschaft weiter und erfordert strenge Aufsicht und öffentliche Beteiligung.
Regulatorische Rahmenbedingungen für CRISPR-basierte epigenetische Interventionen entwickeln sich noch. In den Vereinigten Staaten überwacht die U.S. Food and Drug Administration die Gentherapie und zellbasierte Produkte, aber spezifische Richtlinien für epigenetische Bearbeitung sind in Entwicklung. Die Europäische Arzneimittel-Agentur reguliert ebenfalls fortschrittliche therapeutische Arzneimittel, einschließlich solcher, die Genom- und Epigenom-Bearbeitung betreffen. International haben Organisationen wie die Weltgesundheitsorganisation globale Standards und Governance gefordert, um die einzigartigen Risiken und ethischen Dilemmata, die durch diese Technologien entstehen, anzugehen.
Mit dem Fortschreiten der Forschung wird ein fortlaufender Dialog zwischen Wissenschaftlern, Ethikern, Regulierungsbehörden und der Öffentlichkeit entscheidend sein, um verantwortungsvolle Innovation und die sichere, gerechte Bereitstellung von CRISPR-Cas9-epigenetischer Modulation in der iPSC-Verjüngung zu gewährleisten.
Zukünftige Richtungen: Aufkommende Technologien und Forschungsgrenzen
Die Zukunft der CRISPR-Cas9-epigenetischen Modulation in der Verjüngung induzierter pluripotenter Stammzellen (iPSCs) steht vor bedeutenden Fortschritten, die durch aufkommende Technologien und neuartige Forschungsgrenzen vorangetrieben werden. Eine vielversprechende Richtung ist die Integration von CRISPR-basierter epigenetischer Bearbeitung mit Einzelzell-Multi-Omik, die eine präzise Kartierung und Manipulation von Chromatinzuständen, DNA-Methylierung und Histonmodifikationen auf Einzelzellebene ermöglicht. Dieser Ansatz könnte die Heterogenität von iPSC-Populationen aufdecken und Verjüngungsprotokolle für verbesserte zelluläre Funktion und Langlebigkeit optimieren Nature Reviews Genetics.
Eine weitere Grenze betrifft die Entwicklung von CRISPR-Systemen der nächsten Generation, wie Baseneditoren und Prime-Editoren, die raffiniertere und reversible epigenetische Modifikationen ermöglichen, ohne Doppelstrangbrüche einzuführen. Diese Werkzeuge könnten Off-Target-Effekte und genomische Instabilität minimieren und damit wichtige Sicherheitsbedenken in klinischen Anwendungen ansprechen Cell Stem Cell. Darüber hinaus wird die Verwendung von programmierbaren epigenetischen Effektoren, wie dCas9, das an chromatinmodifizierende Enzyme gebunden ist, untersucht, um altersassoziierte epigenetische Marker zurückzusetzen und jugendliche Genexpressionsprofile in iPSCs wiederherzustellen Science.
In der Zukunft wird erwartet, dass die Konvergenz von künstlicher Intelligenz und maschinellem Lernen mit CRISPR-Technologien die Identifizierung von Verjüngungszielen beschleunigt und optimale Bearbeitungsstrategien vorhersagt. Darüber hinaus werden Fortschritte in den Liefersystemen, wie nanopartikelbasierten oder virusfreien Methoden, die Effizienz und Sicherheit der epigenetischen Bearbeitung in iPSCs verbessern. Insgesamt haben diese Innovationen das Potenzial, die regenerative Medizin und die Modellierung altersassoziierter Krankheiten zu revolutionieren, indem sie präzise, sichere und dauerhafte iPSC-Verjüngung ermöglichen Nature Biotechnology.
Fazit: Der Weg zur iPSC-Verjüngung über CRISPR-Cas9
Die Anwendung der CRISPR-Cas9-vermittelten epigenetischen Modulation in der Verjüngung induzierter pluripotenter Stammzellen (iPSCs) stellt eine transformative Grenze in der regenerativen Medizin dar. Durch die Ermöglichung einer präzisen, locus-spezifischen Bearbeitung von epigenetischen Markierungen bietet diese Technologie das Potenzial, altersassoziierte molekulare Signaturen zurückzusetzen, die Qualität von iPSCs zu verbessern und ihre therapeutische Nützlichkeit zu erhöhen. Jüngste Fortschritte haben die Machbarkeit demonstriert, Schlüsselepigenetische Regulatoren zu zielen, um jugendliche Genexpressionsprofile und funktionale Kapazitäten in iPSCs wiederherzustellen, wodurch Einschränkungen wie restliche epigenetische Erinnerungen und unvollständige Umprogrammierung angegangen werden Nature Reviews Genetics.
Mit Blick auf die Zukunft definieren mehrere Herausforderungen und Chancen den Weg zur klinischen Übersetzung. Die Gewährleistung der Spezifität und Sicherheit der CRISPR-basierten epigenetischen Bearbeitung bleibt von größter Bedeutung, da Off-Target-Effekte und unbeabsichtigte Chromatinveränderungen die Zellfunktion oder Sicherheit gefährden könnten U.S. Food & Drug Administration. Die Entwicklung von CRISPR-Werkzeugen der nächsten Generation mit verbesserter Genauigkeit sowie robusten Liefersystemen wird entscheidend für den Fortschritt dieses Feldes sein. Darüber hinaus wird die Integration von Multi-Omik-Ansätzen zur Überwachung und Validierung von Verjüngungsergebnissen unser Verständnis der zugrunde liegenden Mechanismen verbessern und die regulatorische Genehmigung erleichtern National Human Genome Research Institute.
Letztendlich birgt die Konvergenz von CRISPR-Cas9-Technologie und iPSC-Biologie enormes Potenzial für personalisierte Zelltherapien, Krankheitsmodellierung und das Studium des menschlichen Alterns. Fortgesetzte interdisziplinäre Zusammenarbeit und ethische Aufsicht werden entscheidend sein, um das volle therapeutische Potenzial der iPSC-Verjüngung durch epigenetische Modulation zu realisieren.