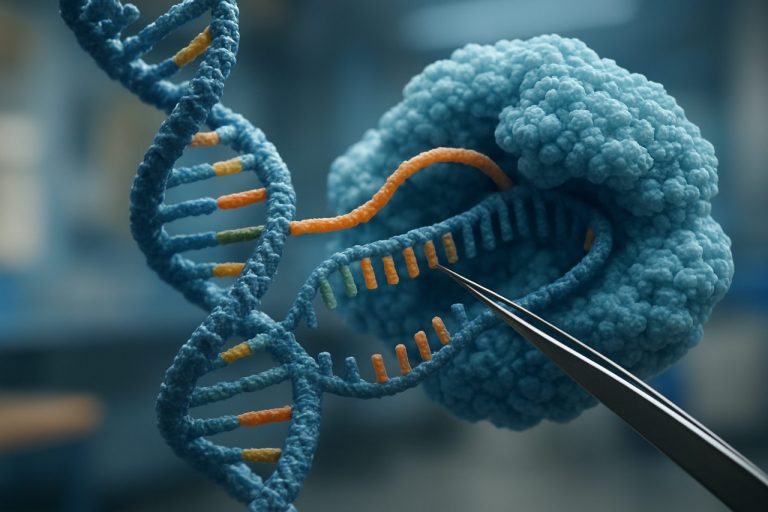
Επαναστατώντας την Έκφραση Γενετικών: Πώς η Μηχανική Επικινδυνότητας μέσω CRISPR Μεταμορφώνει τη Βιοϊατρική Επιστήμη. Ανακαλύψτε την Επόμενη Πρόσκληση στην Ακριβεία Ιατρική και Γενετική Έρευνα.
- Εισαγωγή στη Μηχανική Επικινδυνότητας μέσω CRISPR
- Μηχανισμοί Επικινδυνότητας Βασισμένοι σε CRISPR
- Κλειδιά Εργαλεία και Τεχνολογίες στην Επεξεργασία Επικινδυνότητας
- Εφαρμογές στη Μοντελοποίηση Ασθενειών και Θεραπευτικά
- Προκλήσεις και Περιορισμοί των Τρεχουσών Προσεγγίσεων
- Ηθικές Σκέψεις και Ρυθμιστικό Τοπίο
- Μελλοντικές Κατευθύνσεις και Αναδυόμενες Καινοτομίες
- Πηγές & Αναφορές
Εισαγωγή στη Μηχανική Επικινδυνότητας μέσω CRISPR
Η μηχανική επικινδυνότητας μέσω CRISPR είναι μια καινοτόμος προσέγγιση που εκμεταλλεύεται την ακρίβεια των συστημάτων CRISPR/Cas για να τροποποιήσει την έκφραση γονιδίων χωρίς να αλλάξει την υποκείμενη αλληλουχία DNA. Σε αντίθεση με την παραδοσιακή επεξεργασία γονιδιώματος, η οποία εισάγει μόνιμες γενετικές αλλαγές, η μηχανική επικινδυνότητας στοχεύει τις χημικές τροποποιήσεις—όπως η μεθυλίωση του DNA και οι τροποποιήσεις των ιστονών—που ρυθμίζουν τη δραστηριότητα των γονιδίων. Συνδυάζοντας το καταλυτικά ανενεργό Cas9 (dCas9) με διάφορους τομείς εκτελεστών, οι ερευνητές μπορούν να κατευθύνουν αυτά τα σύμπλοκα σε συγκεκριμένες γενετικές θέσεις, επιτρέποντας την ενεργοποίηση ή καταστολή των στοχευμένων γονιδίων με αναστρέψιμο και προγραμματισμένο τρόπο. Αυτή η τεχνολογία έχει επεκτείνει γρήγορα το εργαλείο για τη λειτουργική γονιδιωματική, τη μοντελοποίηση ασθενειών και τις δυνητικές θεραπευτικές παρεμβάσεις.
Η ευελιξία της μηχανικής επικινδυνότητας μέσω CRISPR έγκειται στην ικανότητά της να στοχεύει σχεδόν οποιοδήποτε γονίδιο ή ρυθμιστικό στοιχείο με υψηλή ειδικότητα, καθοδηγούμενη από προσαρμόσιμες μονοκατευθυντήριες RNA (sgRNAs). Οι εφαρμογές κυμαίνονται από την ανάλυση των ρόλων των ενισχυτών και των σιωπητηρίων στη ρύθμιση των γονιδίων μέχρι την επαναπρογραμματισμένη μοίρα των κυττάρων και τη διόρθωση των ανώμαλων επιγενετικών καταστάσεων που σχετίζονται με ασθένειες όπως ο καρκίνος και οι νευρολογικές διαταραχές. Πρόσφατες εξελίξεις έχουν βελτιώσει την αποδοτικότητα, την ειδικότητα και τις ικανότητες πολυπλοκότητας αυτών των συστημάτων, ανοίγοντας το δρόμο για πιο εξελιγμένες μελέτες των δικτύων ρύθμισης γονιδίων και την ανάπτυξη επιγενετικών θεραπειών. Καθώς το πεδίο εξελίσσεται, η συνεχιζόμενη έρευνα επικεντρώνεται στη βελτιστοποίηση μεθόδων παράδοσης, στη μείωση των εκτός στόχου επιδράσεων και στην κατανόηση των μακροπρόθεσμων συνεπειών των επιγενετικών τροποποιήσεων in vivo Nature Reviews Genetics Cell.
Μηχανισμοί Επικινδυνότητας Βασισμένοι σε CRISPR
Η μηχανική επικινδυνότητας μέσω CRISPR εκμεταλλεύεται την προγραμματισμένη ικανότητα δέσμευσης DNA του καταλυτικά ανενεργού Cas9 (dCas9) που έχει συγχωνευθεί με διάφορους τομείς εκτελεστών για να τροποποιήσει την έκφραση γονιδίων χωρίς να αλλάξει την υποκείμενη αλληλουχία DNA. Ο βασικός μηχανισμός περιλαμβάνει την καθοδήγηση του dCas9 σε συγκεκριμένες γενετικές θέσεις χρησιμοποιώντας μονοκατευθυντήριες RNA (sgRNAs), όπου προσλαμβάνει επιγενετικούς τροποποιητές για να πραγματοποιήσει στοχευμένες αλλαγές στην κατάσταση της χρωματίνης. Για την ενεργοποίηση γονιδίων, το dCas9 συγχωνεύεται συνήθως με ενεργοποιητές μεταγραφής όπως οι VP64, p300 ή συστήματα SunTag, τα οποία τοποθετούν ενεργοποιητικά σημάδια ιστονών (π.χ., H3K27ac) ή προσλαμβάνουν τη μεταγραφική μηχανή, ενισχύοντας έτσι την έκφραση γονιδίων. Αντίθετα, η καταστολή γονιδίων επιτυγχάνεται με τη συγχώνευση του dCas9 με τομείς καταστολής όπως οι KRAB, οι οποίοι προάγουν το σχηματισμό ετεροχρωματίνης μέσω της πρόσληψης ιστονικών μεθυλτρανφερασών και άλλων σιωπητικών συμπλεγμάτων, οδηγώντας σε εναπόθεση κατασταλτικών σημείων όπως το H3K9me3 και επακόλουθη σιωπή στη μεταγραφή Nature Reviews Genetics.
Πέρα από τις τροποποιήσεις ιστονών, τα συστήματα βασισμένα σε CRISPR έχουν προσαρμοστεί για να στοχεύουν τη μεθυλίωση του DNA. Η συγχώνευση του dCas9 με μεθυλτρανφεράσες DNA (π.χ., DNMT3A) ή απομεθυλώσεις (π.χ., TET1) επιτρέπει την προσθήκη ή την αφαίρεση μεθυλικών ομάδων σε συγκεκριμένες θέσεις CpG, παρέχοντας ένα ισχυρό εργαλείο για την ανάλυση των λειτουργικών συνεπειών της μεθυλίωσης του DNA στη ρύθμιση γονιδίων Cell. Οι ικανότητες πολυπλοκότητας επιτρέπουν ταυτόχρονη στόχευση πολλών θέσεων, διευκολύνοντας την πολύπλοκη επαναπρογραμματισμένη επικινδυνότητα. Αυτές οι προσεγγίσεις προσφέρουν υψηλή ειδικότητα και αναστρεψιμότητα, καθιστώντας την επικινδυνότητα βασισμένη σε CRISPR μια ευέλικτη πλατφόρμα για τη λειτουργική γονιδιωματική, τη μοντελοποίηση ασθενειών και τις δυνητικές θεραπευτικές παρεμβάσεις Nature Reviews Genetics.
Κλειδιά Εργαλεία και Τεχνολογίες στην Επεξεργασία Επικινδυνότητας
Η μηχανική επικινδυνότητας μέσω CRISPR εκμεταλλεύεται την προγραμματισμένη ικανότητα δέσμευσης DNA του συστήματος CRISPR-Cas9, ιδιαίτερα χρησιμοποιώντας το καταλυτικά ανενεργό Cas9 (dCas9), για να στοχεύσει συγκεκριμένες γενετικές θέσεις χωρίς να προκαλεί διπλές διακοπές. Η βασική καινοτομία έγκειται στη συγχώνευση του dCas9 με διάφορους τομείς εκτελεστών που μπορούν να τροποποιήσουν τις καταστάσεις χρωματίνης και την έκφραση γονιδίων. Μεταξύ των πιο ευρέως χρησιμοποιούμενων εκτελεστών είναι οι μεθυλτρανφεράσες DNA (π.χ., DNMT3A), οι απομεθυλώσεις (π.χ., TET1), οι ακετυλοτρανφεράσες ιστονών (π.χ., p300) και οι αποακετυλοτρανφεράσες ιστονών (π.χ., HDACs). Αυτές οι συγχωνεύσεις επιτρέπουν την προσθήκη ή αφαίρεση επιγενετικών σημείων, όπως η μεθυλίωση του DNA ή οι τροποποιήσεις ιστονών, ελέγχοντας έτσι τη δραστηριότητα των γονιδίων με έναν αναστρέψιμο και ρυθμιζόμενο τρόπο.
Πρόσφατες εξελίξεις έχουν επεκτείνει το εργαλείο CRISPR για να περιλαμβάνει συστήματα όπως η παρέμβαση CRISPR (CRISPRi) και η ενεργοποίηση CRISPR (CRISPRa), τα οποία χρησιμοποιούν το dCas9 συγχωνευμένο με κατασταλτικούς παράγοντες (π.χ., KRAB) ή ενεργοποιητές (π.χ., VP64, p65, Rta) για να τροποποιήσουν την έκφραση γονιδίων χωρίς να αλλάξουν την υποκείμενη αλληλουχία DNA. Στρατηγικές πολυπλοκότητας, χρησιμοποιώντας πολλαπλές μονοκατευθυντήριες RNA, επιτρέπουν ταυτόχρονη στόχευση αρκετών θέσεων, διευκολύνοντας την πολύπλοκη επαναπρογραμματισμένη επικινδυνότητα. Επιπλέον, τα συστήματα που είναι αναστρέψιμα και προκαλούμενα, όπως αυτά που βασίζονται σε φως ή μικρά μόρια, παρέχουν χρονικό έλεγχο πάνω στις επιγενετικές τροποποιήσεις.
Αναδυόμενες τεχνολογίες, συμπεριλαμβανομένων των επεξεργαστών βάσης και των βασικών επεξεργαστών, προσαρμόζονται για την επεξεργασία επικινδυνότητας, ενισχύοντας περαιτέρω την ειδικότητα και ελαχιστοποιώντας τις εκτός στόχου επιδράσεις. Η ενσωμάτωση προσεγγίσεων μονοκυττάρου και υψηλής απόδοσης επιταχύνει την λειτουργική ανάλυση των ρυθμιστικών στοιχείων και την ανακάλυψη νέων επιγενετικών μηχανισμών. Συλλογικά, αυτά τα εργαλεία μεταμορφώνουν την ικανότητά μας να αναλύουμε και να χειριζόμαστε την επικινδυνότητα με απαράμιλλη ακρίβεια Nature Reviews Genetics Cell.
Εφαρμογές στη Μοντελοποίηση Ασθενειών και Θεραπευτικά
Η μηχανική επικινδυνότητας μέσω CRISPR έχει αναδειχθεί γρήγορα ως ένα μετασχηματιστικό εργαλείο στη μοντελοποίηση ασθενειών και την ανάπτυξη θεραπειών. Με τη συγχώνευση του καταλυτικά ανενεργού Cas9 (dCas9) με επιγενετικούς τροποποιητές, οι ερευνητές μπορούν να τροποποιήσουν με ακρίβεια την έκφραση γονιδίων χωρίς να αλλάξουν την υποκείμενη αλληλουχία DNA. Αυτή η προσέγγιση επιτρέπει την αναστρέψιμη ενεργοποίηση ή καταστολή των στοχευμένων γονιδίων, παρέχοντας μια ισχυρή πλατφόρμα για την ανάλυση της γονιδιακής λειτουργίας και τη μοντελοποίηση καταστάσεων ασθενειών in vitro και in vivo. Για παράδειγμα, τα συστήματα βασισμένα σε dCas9 έχουν χρησιμοποιηθεί για να αναπαραστήσουν τις επιγενετικές αλλαγές που σχετίζονται με ασθένειες σε κυτταρικά μοντέλα, επιτρέποντας τη μελέτη πολύπλοκων διαταραχών όπως ο καρκίνος, η νευροεκφύλιση και οι ασθένειες εκτύπωσης Nature Reviews Genetics.
Στις θεραπείες, η επεξεργασία επικινδυνότητας μέσω CRISPR προσφέρει τη δυνατότητα διόρθωσης ανώμαλων προφίλ έκφρασης γονιδίων που υποκρύπτουν διάφορες ασθένειες. Σε αντίθεση με την παραδοσιακή γονιδιακή επεξεργασία, η οποία εισάγει μόνιμες αλλαγές στο DNA, η μηχανική επικινδυνότητας μπορεί να επιτύχει θεραπευτικά αποτελέσματα μέσω παροδικών και δυνητικά αναστρέψιμων τροποποιήσεων. Αυτό είναι ιδιαίτερα ευνοϊκό για καταστάσεις όπου απαιτείται ακριβής χρονικός έλεγχος της έκφρασης γονιδίων ή όπου μόνιμες γενετικές τροποποιήσεις εγείρουν ανησυχίες για την ασφάλεια. Πρόσφατες προκλινικές μελέτες έχουν αποδείξει τη δυνατότητα χρήσης συγχωνεύσεων dCas9-επιγενετικού εκτελεστή για την επανενεργοποίηση σιωπημένων γονιδίων καταστολής όγκων ή την καταστολή ογκογόνων σε μοντέλα καρκίνου, καθώς και για την τροποποίηση γονιδίων που εμπλέκονται σε νευρολογικές και μεταβολικές διαταραχές Cell.
Παρά αυτές τις προόδους, παραμένουν προκλήσεις, συμπεριλαμβανομένης της αποτελεσματικής παράδοσης σε στοχευμένους ιστούς, της ελαχιστοποίησης των εκτός στόχου επιδράσεων και της εξασφάλισης μακροπρόθεσμης ασφάλειας. Η συνεχιζόμενη έρευνα στοχεύει στη βελτιστοποίηση των συστημάτων παράδοσης και στη βελτίωση της ειδικότητας των εκτελεστών, ανοίγοντας το δρόμο για κλινική μετάφραση των θεραπειών επικινδυνότητας βασισμένων σε CRISPR Nature Biotechnology.
Προκλήσεις και Περιορισμοί των Τρεχουσών Προσεγγίσεων
Παρά το μετασχηματιστικό δυναμικό της μηχανικής επικινδυνότητας μέσω CRISPR, αρκετές προκλήσεις και περιορισμοί εμποδίζουν την ευρεία εφαρμογή και κλινική μετάφραση της. Μία από τις κύριες ανησυχίες είναι η ειδικότητα της στόχευσης. Ενώ τα συστήματα CRISPR-dCas9 μπορούν να προγραμματιστούν για να δεσμεύουν συγκεκριμένες γενετικές θέσεις, η δέσμευση εκτός στόχου και οι μη επιθυμητές επιγενετικές τροποποιήσεις παραμένουν σημαντικοί κίνδυνοι, ενδεχομένως οδηγώντας σε απρόβλεπτες αλλαγές στην έκφραση γονιδίων ή γενετική αστάθεια. Οι προσπάθειες για τη βελτίωση του σχεδιασμού των μονοκατευθυντήριων RNA και την κατασκευή παραλλαγών dCas9 υψηλής πιστότητας είναι σε εξέλιξη, αλλά η πλήρης εξάλειψη των εκτός στόχου επιδράσεων δεν έχει επιτευχθεί ακόμη Nature Reviews Genetics.
Ένας άλλος περιορισμός είναι η αποδοτικότητα και η διάρκεια των επιγενετικών τροποποιήσεων. Σε αντίθεση με τις μόνιμες γενετικές επεξεργασίες, οι επιγενετικές αλλαγές που προκαλούνται από τους εκτελεστές βασισμένους σε CRISPR μπορεί να είναι παροδικές ή αναστρέψιμες, ειδικά σε διαιρούμενα κύτταρα όπου οι καταστάσεις χρωματίνης ρυθμίζονται δυναμικά. Αυτό θέτει προκλήσεις για εφαρμογές που απαιτούν μακροχρόνια ρύθμιση γονιδίων, όπως σε θεραπευτικά περιβάλλοντα Cell. Επιπλέον, η παράδοση μεγάλων πρωτεϊνών συγχώνευσης CRISPR-dCas9 και σχετικών μονοκατευθυντήριων RNA σε στοχευμένα κύτταρα ή ιστούς παραμένει τεχνικά προκλητική, ιδιαίτερα in vivo, όπου τα οχήματα παράδοσης πρέπει να ξεπεράσουν βιολογικά εμπόδια και να αποφύγουν ανοσοποιητικές αντιδράσεις Nature Biotechnology.
Τέλος, η πολυπλοκότητα της επικινδυνότητας από μόνη της παρουσιάζει πρόκληση. Η αλληλεπίδραση μεταξύ διαφορετικών επιγενετικών σημείων και οι εξαρτώμενες από το πλαίσιο επιδράσεις τους στην έκφραση γονιδίων δεν είναι πλήρως κατανοητές, καθιστώντας δύσκολη την πρόβλεψη των αποτελεσμάτων των στοχευμένων τροποποιήσεων. Ως αποτέλεσμα, οι εκτενείς προκλινικές μελέτες και οι βελτιωμένες μηχανιστικές προσεγγίσεις είναι απαραίτητες προτού η μηχανική επικινδυνότητας μέσω CRISPR μπορέσει να εφαρμοστεί με ασφάλεια και αποτελεσματικότητα σε κλινικά περιβάλλοντα.
Ηθικές Σκέψεις και Ρυθμιστικό Τοπίο
Η μηχανική επικινδυνότητας μέσω CRISPR, η οποία επιτρέπει ακριβείς και αναστρέψιμες τροποποιήσεις της έκφρασης γονιδίων χωρίς να αλλάξει την υποκείμενη αλληλουχία DNA, εγείρει μοναδικές ηθικές και ρυθμιστικές προκλήσεις που διαφέρουν από αυτές που σχετίζονται με την παραδοσιακή επεξεργασία γονιδιώματος. Μία από τις κύριες ηθικές ανησυχίες είναι η πιθανότητα μη επιθυμητών επιδράσεων εκτός στόχου, οι οποίες θα μπορούσαν να οδηγήσουν σε απρόβλεπτες αλλαγές στη ρύθμιση γονιδίων και επακόλουθες βιολογικές συνέπειες. Αυτός ο κίνδυνος είναι ιδιαίτερα σημαντικός σε κλινικές εφαρμογές, όπου τα δεδομένα μακροχρόνιας ασφάλειας είναι περιορισμένα. Επιπλέον, η ικανότητα τροποποίησης της έκφρασης γονιδίων με κληρονομήσιμη ή μη κληρονομήσιμη μορφή θολώνει τη γραμμή μεταξύ σωματικών και γενετικών παρεμβάσεων, περιπλέκοντας τα υπάρχοντα ηθικά πλαίσια και μηχανισμούς εποπτείας.
Από ρυθμιστική άποψη, το τοπίο εξακολουθεί να εξελίσσεται. Στις Ηνωμένες Πολιτείες, η Υπηρεσία Τροφίμων και Φαρμάκων (FDA) επιβλέπει τα προϊόντα γονιδιακής θεραπείας, αλλά υπάρχει συνεχής συζήτηση σχετικά με το πώς να ταξινομηθούν και να ρυθμιστούν τα εργαλεία επεξεργασίας επικινδυνότητας, ιδίως αυτά που δεν εισάγουν μόνιμες γενετικές αλλαγές. Ο Ευρωπαϊκός Οργανισμός Φαρμάκων και άλλοι διεθνείς φορείς αναζητούν επίσης τρόπους προσαρμογής των τρεχουσών κατευθυντήριων γραμμών για να αντιμετωπίσουν τους μοναδικούς κινδύνους και τα οφέλη των επιγενετικών παρεμβάσεων. Ζητήματα όπως η ενημερωμένη συγκατάθεση, η δίκαιη πρόσβαση και η πιθανή κακή χρήση για μη θεραπευτικές βελτιώσεις περιπλέκουν περαιτέρω το ρυθμιστικό περιβάλλον.
Καθώς η τεχνολογία προχωρά, υπάρχει μια αυξανόμενη συναίνεση σχετικά με την ανάγκη για ισχυρή ηθική εποπτεία, διαφανή δημόσια συμμετοχή και διεθνή εναρμόνιση των ρυθμιστικών προτύπων για να διασφαλιστεί η υπεύθυνη ανάπτυξη και εφαρμογή της μηχανικής επικινδυνότητας μέσω CRISPR Nature Biotechnology.
Μελλοντικές Κατευθύνσεις και Αναδυόμενες Καινοτομίες
Το μέλλον της μηχανικής επικινδυνότητας μέσω CRISPR είναι έτοιμο για μετασχηματιστικές προόδους, καθοδηγούμενες από καινοτομίες τόσο στην ανάπτυξη εργαλείων όσο και στην εφαρμογή τους. Μια υποσχόμενη κατεύθυνση είναι η βελτίωση των επεξεργαστών επιγενετικής βασισμένων σε CRISPR για να επιτευχθεί υψηλότερη ειδικότητα και μειωμένες εκτός στόχου επιδράσεις. Αυτό περιλαμβάνει τη μηχανική κατασκευή νέων πρωτεϊνών συγχώνευσης dCas9 με βελτιωμένη ακρίβεια στόχευσης και την ικανότητα τροποποίησης ενός ευρύτερου φάσματος επιγενετικών σημείων, όπως οι τροποποιήσεις ιστονών και οι αλληλεπιδράσεις μη κωδικοποιημένου RNA, πέρα από τη μεθυλίωση και την ακετυλίωση του DNA Nature Reviews Genetics.
Μια άλλη αναδυόμενη καινοτομία είναι η ενσωμάτωση αναστρέψιμων και προκαλούμενων συστημάτων, επιτρέποντας τον χρονικό έλεγχο των επιγενετικών τροποποιήσεων. Αυτά τα συστήματα επιτρέπουν στους ερευνητές να μελετούν τη δυναμική ρύθμιση γονιδίων και τη μνήμη των κυττάρων με απαράμιλλη ανάλυση, η οποία είναι κρίσιμη για την κατανόηση της ανάπτυξης, της προόδου των ασθενειών και των θεραπευτικών αποκρίσεων Cell. Επιπλέον, η πολυπλοκότητα στην επεξεργασία επικινδυνότητας—στοχεύοντας ταυτόχρονα πολλές θέσεις ή επιγενετικά σημεία—υπόσχεται να αναλύσει πολύπλοκα δίκτυα ρύθμισης γονιδίων και εφαρμογές συνθετικής βιολογίας.
Στον τομέα της μετάφρασης, η μηχανική επικινδυνότητας μέσω CRISPR εξερευνάται για θεραπευτικές παρεμβάσεις σε ασθένειες με επιγενετικές ρίζες, όπως ο καρκίνος, οι νευροεκφυλιστικές διαταραχές και οι ασθένειες εκτύπωσης. Η ανάπτυξη συστημάτων παράδοσης που είναι τόσο αποτελεσματικά όσο και ειδικά για τύπους κυττάρων παραμένει κρίσιμη πρόκληση, αλλά οι πρόοδοι στις τεχνολογίες νανοσωματιδίων και ιικών φορέων επεκτείνουν γρήγορα τη δυνατότητα εφαρμογών in vivo Nature Biotechnology.
Συνολικά, η σύγκλιση της τεχνολογίας CRISPR με την επιγενετική αναμένεται να ανοίξει νέες προοπτικές στη βασική έρευνα, τη μοντελοποίηση ασθενειών και την ακριβή ιατρική, προαναγγέλλοντας μια νέα εποχή προγραμματισμένης ρύθμισης γονιδίων.