Comment la modulation épigénétique CRISPR-Cas9 révolutionne le rajeunissement des cellules souches pluripotentes induites (iPSC) — Une plongée approfondie dans la science et le potentiel futur
- Introduction au rajeunissement des iPSC et à la modulation épigénétique
- CRISPR-Cas9 : Mécanismes et innovations dans l’édition épigénétique
- Cibles épigénétiques clés pour le rajeunissement des iPSC
- Avancées récentes : études de cas et résultats expérimentaux
- Défis et limites de la modulation épigénétique CRISPR-Cas9
- Implications thérapeutiques et applications en médecine régénérative
- Considérations éthiques et paysage réglementaire
- Directions futures : technologies émergentes et frontières de recherche
- Conclusion : La voie à suivre pour le rajeunissement des iPSC via CRISPR-Cas9
- Sources & Références
Introduction au rajeunissement des iPSC et à la modulation épigénétique
Les cellules souches pluripotentes induites (iPSCs) sont des cellules somatiques reprogrammées à un état pluripotent, leur permettant de se différencier en divers types cellulaires et offrant un potentiel immense pour la médecine régénérative et la modélisation des maladies. Cependant, les iPSCs conservent souvent une mémoire épigénétique résiduelle de leurs cellules d’origine, ce qui peut limiter leur plein potentiel de rajeunissement et de différenciation. La modulation épigénétique — altérer les modifications chimiques sur l’ADN ou les histones sans changer le code génétique sous-jacent — a émergé comme une stratégie prometteuse pour améliorer le rajeunissement des iPSCs en réinitialisant ces marques épigénétiques à un état plus semblable à celui des embryons.
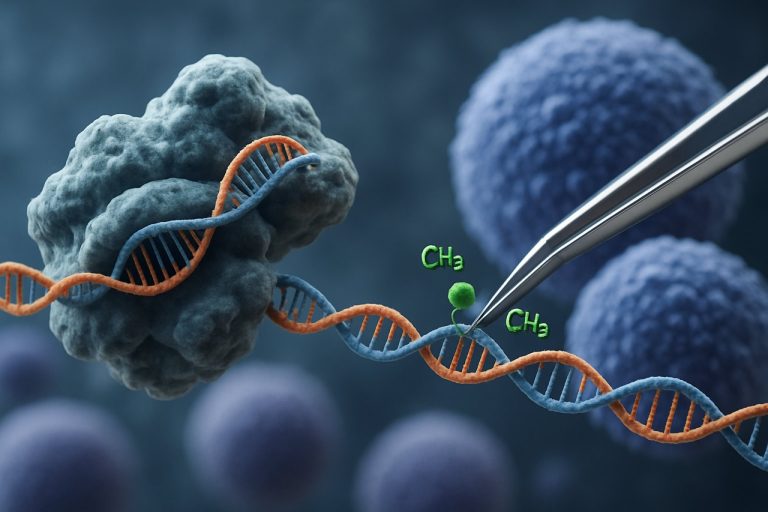
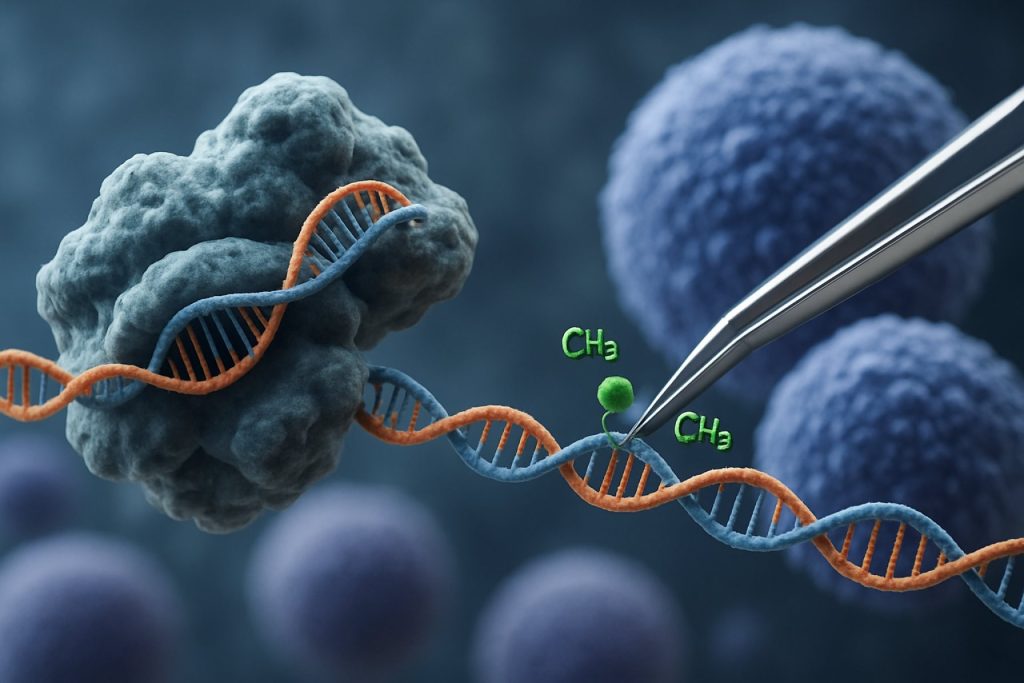
L’avènement de la technologie CRISPR-Cas9 a révolutionné le domaine de l’édition épigénétique. Contrairement aux applications CRISPR traditionnelles qui induisent des cassures double-brin pour l’édition génique, la modulation épigénétique basée sur CRISPR utilise un Cas9 catalytiquement inactif (dCas9) fusionné à des domaines effecteurs épigénétiques. Ce système permet une modification précise et spécifique à un locus des marques épigénétiques, telles que la méthylation de l’ADN ou l’acétylation des histones, permettant ainsi un reprogrammation ciblée des profils d’expression génique dans les iPSCs. De telles interventions ciblées peuvent effacer les signatures épigénétiques associées à l’âge ou spécifiques à la lignée, favorisant un rajeunissement plus complet des iPSCs et améliorant leurs propriétés fonctionnelles.
Des études récentes ont démontré la faisabilité d’utiliser des systèmes CRISPR-dCas9 pour moduler des gènes associés au rajeunissement et des régulateurs épigénétiques clés dans les iPSCs, ouvrant la voie à des thérapies cellulaires plus efficaces et plus sûres. À mesure que le domaine avance, l’intégration de la modulation épigénétique CRISPR-Cas9 avec la technologie des iPSCs présente un potentiel significatif pour surmonter les limitations actuelles de la reprogrammation cellulaire et pour le développement d’approches de médecine régénérative personnalisée (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9 : Mécanismes et innovations dans l’édition épigénétique
Le système CRISPR-Cas9, initialement développé pour l’édition précise du génome, a été adapté de manière innovante pour la modulation épigénétique ciblée, offrant de nouvelles avenues pour le rajeunissement des cellules souches pluripotentes induites (iPSCs). Contrairement au CRISPR-Cas9 traditionnel, qui introduit des cassures double-brin pour éditer des séquences d’ADN, l’édition épigénétique utilise un Cas9 inactif catalytiquement (dCas9) fusionné à des domaines effecteurs épigénétiques. Cela permet une modification spécifique à un locus des états de la chromatine — tels que la méthylation de l’ADN ou l’acétylation des histones — sans altérer le code génétique sous-jacent. Une telle précision est cruciale pour le rajeunissement des iPSCs, où la réinitialisation du paysage épigénétique peut restaurer des profils d’expression génique juvéniles et améliorer la fonction cellulaire.
Les innovations récentes incluent des dCas9 fusionnés à des méthyltransférases ou déméthylases de l’ADN, ainsi qu’à des acétyltransférases ou désacétylases d’histones, permettant l’activation ou la répression réversibles de gènes cibles impliqués dans le vieillissement et la sénescence. Par exemple, la déméthylation ciblée des promoteurs de gènes de pluripotence peut réactiver leur expression, améliorant ainsi la qualité des iPSCs et leur potentiel de différenciation. De plus, l’édition épigénétique multiplexée — ciblant simultanément plusieurs loci — a été démontrée, améliorant encore le processus de rajeunissement en orchestrant des réseaux régulateurs géniques complexes Nature Reviews Genetics.
Ces avancées sont complétées par des systèmes de livraison améliorés, tels que des complexes ribonucléoprotéiques et des vecteurs viraux, qui augmentent l’efficacité de l’édition et réduisent les effets hors cible. Collectivement, l’édition épigénétique basée sur CRISPR-Cas9 représente une approche transformative pour le rajeunissement des iPSCs, avec le potentiel de surmonter les limitations du reprogrammation conventionnelle et d’ouvrir la voie à des thérapies régénératives Cell Stem Cell.
Cibles épigénétiques clés pour le rajeunissement des iPSC
Un aspect critique de l’utilisation de CRISPR-Cas9 pour la modulation épigénétique dans le rajeunissement des cellules souches pluripotentes induites (iPSC) est l’identification et le ciblage de régulateurs épigénétiques clés qui gouvernent le vieillissement cellulaire et la pluripotence. Parmi les cibles les plus importantes figurent les motifs de méthylation de l’ADN, les modifications des histones et les loci d’ARN non codants, qui jouent tous des rôles essentiels dans le maintien ou l’effacement de la mémoire cellulaire lors de la reprogrammation. Par exemple, l’état de méthylation du promoteur de p16INK4a, un marqueur de sénescence bien connu, a été montré pour influencer la capacité proliférative et le potentiel de rajeunissement des iPSCs. Les systèmes CRISPR-dCas9 fusionnés avec des déméthylases ou méthyltransférases de l’ADN peuvent être dirigés avec précision vers de tels loci pour moduler leur état épigénétique, améliorant ainsi l’efficacité de la reprogrammation et la jeunesse cellulaire Nature Reviews Genetics.
Une autre cible clé est la régulation des modifications des histones, telles que H3K9me3 et H3K27me3, qui sont associées à la formation d’hétérochromatine et au silence génique. L’édition ciblée de ces marques dans des régions génomiques spécifiques à l’aide de CRISPR-dCas9 fusionné à des enzymes modifiant les histones peut réactiver des gènes de pluripotence ou réprimer des gènes associés au vieillissement, facilitant ainsi un processus de rajeunissement plus robuste Cell Stem Cell. De plus, les ARN longs non codants (lncRNAs) qui modulent l’architecture de la chromatine et l’expression génique émergent comme des cibles CRISPR prometteuses pour affiner le paysage épigénétique des iPSCs Nature Cell Biology.
Dans l’ensemble, la sélection stratégique et la modulation précise de ces cibles épigénétiques à l’aide d’outils basés sur CRISPR-Cas9 présentent un potentiel significatif pour faire progresser le rajeunissement des iPSCs et le développement de thérapies régénératives.
Avancées récentes : études de cas et résultats expérimentaux
Ces dernières années, des progrès significatifs ont été réalisés dans l’utilisation de la modulation épigénétique basée sur CRISPR-Cas9 pour rajeunir les cellules souches pluripotentes induites (iPSCs). Notamment, plusieurs études ont démontré la faisabilité d’utiliser un Cas9 inactif catalytiquement (dCas9) fusionné à des modificateurs épigénétiques pour cibler et remodeler des régions spécifiques de la chromatine, inversant ainsi les marques épigénétiques associées à l’âge dans les iPSCs. Par exemple, une étude marquante de Nature a rapporté l’utilisation de dCas9-TET1 pour déméthyler les régions promotrices de gènes clés de pluripotence, entraînant une efficacité de reprogrammation améliorée et de meilleurs marqueurs de rajeunissement cellulaire.
Une autre expérience clé publiée par Cell Stem Cell a utilisé dCas9-p300 pour acétyler l’histone H3K27 dans des loci associés à des profils d’expression génique juvéniles. Cette édition épigénétique ciblée a non seulement restauré des signatures transcriptionnelles juvéniles, mais a également amélioré la fonction mitochondriale et réduit les phénotypes associés à la sénescence dans les iPSCs dérivés de donneurs âgés.
De plus, une étude préclinique récente publiée par Science a démontré que l’édition épigénétique multiplexée CRISPR-dCas9 pouvait moduler simultanément plusieurs voies liées au vieillissement, entraînant des effets synergiques sur le rajeunissement des iPSCs. Ces résultats soulignent collectivement le potentiel de la modulation épigénétique CRISPR-Cas9 en tant qu’outil précis et polyvalent pour inverser le vieillissement cellulaire dans les iPSCs, ouvrant la voie à de futures applications translationnelles en médecine régénérative et en modélisation des maladies liées à l’âge.
Défis et limites de la modulation épigénétique CRISPR-Cas9
Malgré le potentiel transformateur de la modulation épigénétique basée sur CRISPR-Cas9 dans le rajeunissement des cellules souches pluripotentes induites (iPSCs), plusieurs défis et limites persistent. Une préoccupation majeure est celle des effets hors cible, où le système CRISPR-Cas9 peut se lier involontairement à des loci génomiques non intentionnels et les modifier, ce qui peut entraîner des changements épigénétiques imprévisibles et une instabilité génomique. Cela est particulièrement critique dans le contexte du rajeunissement des iPSCs, car même de petites modifications hors cible peuvent compromettre la pluripotence ou déclencher des voies oncogéniques Nature Reviews Genetics.
Une autre limite réside dans l’efficacité et la spécificité de l’édition épigénétique. Bien que le Cas9 inactif catalytiquement (dCas9) fusionné à des modificateurs épigénétiques puisse cibler des loci spécifiques, le degré et la persistance des changements épigénétiques — tels que la méthylation de l’ADN ou la modification des histones — sont souvent variables et peuvent ne pas reproduire pleinement le paysage épigénétique juvénile requis pour un rajeunissement robuste des iPSCs Cell Stem Cell. De plus, la livraison des composants CRISPR-dCas9 dans les iPSCs reste techniquement difficile, les vecteurs viraux présentant des risques de mutagenèse d’insertion et les méthodes non virales souffrant souvent d’une faible efficacité.
L’immunogénicité est une autre préoccupation, car l’introduction de protéines exogènes telles que Cas9 peut déclencher des réponses immunitaires, en particulier dans les applications cliniques. De plus, la stabilité à long terme et la sécurité des iPSCs modifiées épigénétiquement n’ont pas encore été pleinement établies, soulevant des questions sur leur adéquation à un usage thérapeutique U.S. Food & Drug Administration. S’attaquer à ces défis est essentiel pour la traduction sûre et efficace des stratégies de modulation épigénétique CRISPR-Cas9 dans le rajeunissement des iPSCs.
Implications thérapeutiques et applications en médecine régénérative
L’application de la modulation épigénétique basée sur CRISPR-Cas9 dans le rajeunissement des cellules souches pluripotentes induites (iPSCs) présente un potentiel significatif pour les interventions thérapeutiques et la médecine régénérative. En ciblant et en modifiant précisément les marques épigénétiques — telles que la méthylation de l’ADN et les modifications des histones — à des loci génomiques spécifiques, les chercheurs peuvent inverser les changements épigénétiques associés à l’âge dans les iPSCs, améliorant ainsi leur pluripotence, leur stabilité génomique et leur potentiel de différenciation. Ce processus de rajeunissement est crucial pour générer des iPSCs de haute qualité adaptées aux thérapies de remplacement cellulaire, à la modélisation des maladies et au dépistage de médicaments.
En médecine régénérative, les iPSCs rajeunies peuvent être différenciées en divers types cellulaires avec une fonctionnalité améliorée et un risque réduit de sénescence ou de tumorigenicité, répondant ainsi aux principales préoccupations de sécurité dans les applications cliniques. Par exemple, l’édition épigénétique de gènes impliqués dans le vieillissement cellulaire, tels que p16INK4a ou TERT, peut restaurer des profils d’expression génique juvéniles et la longueur des télomères, améliorant l’efficacité thérapeutique des cellules dérivées. De plus, les protéines de fusion CRISPR-dCas9 liées à des modificateurs épigénétiques permettent une modulation réversible et spécifique à un locus, minimisant les effets hors cible et les altérations génomiques permanentes, ce qui est crucial pour la traduction clinique Nature Reviews Genetics.
La capacité de rajeunir les iPSCs dérivées de patients ouvre également des voies pour des thérapies régénératives personnalisées, où des cellules autologues peuvent être rajeunies, corrigées pour des mutations causant des maladies, et différenciées en tissus fonctionnels pour la transplantation. Cette approche a le potentiel de traiter un large éventail de maladies dégénératives, y compris les troubles neurodégénératifs, les maladies cardiovasculaires et le diabète, en fournissant une source renouvelable de cellules juvéniles et spécifiques au patient Cell Stem Cell. À mesure que la technologie mûrit, l’intégration de la modulation épigénétique CRISPR-Cas9 avec des thérapies basées sur les iPSCs pourrait révolutionner le paysage de la médecine régénérative.
Considérations éthiques et paysage réglementaire
L’application de la modulation épigénétique médiée par CRISPR-Cas9 dans le rajeunissement des cellules souches pluripotentes induites (iPSCs) présente d’importants défis éthiques et réglementaires. Contrairement à l’édition génique traditionnelle, la modulation épigénétique ne modifie pas la séquence de l’ADN mais modifie plutôt l’expression génique par des changements réversibles, tels que la méthylation de l’ADN ou la modification des histones. Bien que cela puisse réduire certaines préoccupations associées aux altérations génétiques permanentes, les effets à long terme et le potentiel d’impacts hors cible restent incertains, soulevant des questions sur la sécurité et les conséquences imprévues dans les applications cliniques.
Éthiquement, l’utilisation de CRISPR-Cas9 dans le rajeunissement des iPSCs s’entrecroise avec des débats sur l’amélioration humaine, le consentement et le potentiel de transmission germinale si des cellules rajeunies sont utilisées dans des contextes reproductifs. Il y a également des préoccupations concernant l’accès équitable à de telles thérapies avancées, qui pourraient exacerber les disparités de santé existantes. La possibilité de créer des cellules ou des tissus « conçus » complique encore le paysage éthique, nécessitant une surveillance robuste et un engagement public.
Les cadres réglementaires pour les interventions épigénétiques basées sur CRISPR sont encore en évolution. Aux États-Unis, la U.S. Food and Drug Administration supervise les thérapies géniques et les produits basés sur des cellules, mais des directives spécifiques pour l’édition épigénétique sont en cours de développement. L’Agence européenne des médicaments régule également les produits médicinaux de thérapie avancée, y compris ceux impliquant l’édition du génome et de l’épigénome. À l’international, des organisations telles que l’Organisation mondiale de la santé ont appelé à des normes et à une gouvernance mondiales pour traiter les risques uniques et les dilemmes éthiques posés par ces technologies.
À mesure que la recherche progresse, un dialogue continu entre scientifiques, éthiciens, régulateurs et le public sera essentiel pour garantir une innovation responsable et le déploiement sûr et équitable de la modulation épigénétique CRISPR-Cas9 dans le rajeunissement des iPSCs.
Directions futures : technologies émergentes et frontières de recherche
L’avenir de la modulation épigénétique CRISPR-Cas9 dans le rajeunissement des cellules souches pluripotentes induites (iPSCs) est prêt pour des avancées significatives, propulsées par des technologies émergentes et de nouvelles frontières de recherche. Une direction prometteuse est l’intégration de l’édition épigénétique basée sur CRISPR avec des multi-omiques unicellulaires, permettant une cartographie précise et une manipulation des états de la chromatine, de la méthylation de l’ADN et des modifications des histones au niveau de chaque cellule. Cette approche pourrait déchiffrer l’hétérogénéité des populations d’iPSCs et optimiser les protocoles de rajeunissement pour améliorer la fonction cellulaire et la longévité Nature Reviews Genetics.
Une autre frontière implique le développement de systèmes CRISPR de nouvelle génération, tels que les éditeurs de bases et les éditeurs primaires, qui permettent des modifications épigénétiques plus raffinées et réversibles sans introduire de cassures double-brin. Ces outils pourraient minimiser les effets hors cible et l’instabilité génomique, abordant des préoccupations clés en matière de sécurité dans les applications cliniques Cell Stem Cell. De plus, l’utilisation d’effecteurs épigénétiques programmables, tels que dCas9 fusionné à des enzymes modifiant la chromatine, est explorée pour réinitialiser les marques épigénétiques associées à l’âge et restaurer des profils d’expression génique juvéniles dans les iPSCs Science.
À l’avenir, la convergence de l’intelligence artificielle et de l’apprentissage automatique avec les technologies CRISPR devrait accélérer l’identification des cibles de rajeunissement et prédire les stratégies d’édition optimales. De plus, les avancées dans les systèmes de livraison, tels que les méthodes basées sur des nanoparticules ou sans virus, amélioreront l’efficacité et la sécurité de l’édition épigénétique dans les iPSCs. Collectivement, ces innovations ont le potentiel de révolutionner la médecine régénérative et la modélisation des maladies liées à l’âge en permettant un rajeunissement précis, sûr et durable des iPSCs Nature Biotechnology.
Conclusion : La voie à suivre pour le rajeunissement des iPSC via CRISPR-Cas9
L’application de la modulation épigénétique médiée par CRISPR-Cas9 dans le rajeunissement des cellules souches pluripotentes induites (iPSCs) représente une frontière transformative en médecine régénérative. En permettant un édition précise et spécifique à un locus des marques épigénétiques, cette technologie offre le potentiel de réinitialiser les signatures moléculaires associées à l’âge, d’améliorer la qualité des iPSCs et d’augmenter leur utilité thérapeutique. Des avancées récentes ont démontré la faisabilité de cibler des régulateurs épigénétiques clés pour restaurer des profils d’expression génique juvéniles et des capacités fonctionnelles dans les iPSCs, abordant ainsi des limites telles que la mémoire épigénétique résiduelle et la reprogrammation incomplète Nature Reviews Genetics.
À l’avenir, plusieurs défis et opportunités définissent la voie vers la traduction clinique. Assurer la spécificité et la sécurité de l’édition épigénétique basée sur CRISPR reste primordial, car les effets hors cible et les altérations chromatiniennes imprévues pourraient compromettre la fonction cellulaire ou la sécurité U.S. Food & Drug Administration. Le développement d’outils CRISPR de nouvelle génération avec une fidélité améliorée, ainsi que des systèmes de livraison robustes, sera crucial pour faire avancer ce domaine. De plus, l’intégration d’approches multi-omiques pour surveiller et valider les résultats du rajeunissement améliorera notre compréhension des mécanismes sous-jacents et facilitera l’approbation réglementaire National Human Genome Research Institute.
En fin de compte, la convergence de la technologie CRISPR-Cas9 et de la biologie des iPSCs détient un immense potentiel pour des thérapies cellulaires personnalisées, la modélisation des maladies et l’étude du vieillissement humain. Une collaboration interdisciplinaire continue et une surveillance éthique seront essentielles pour réaliser le plein potentiel thérapeutique du rajeunissement des iPSCs via la modulation épigénétique.