Kako epigenetska modulacija CRISPR-Cas9 revolucionira pomlađivanje induciranih pluripotentnih matičnih stanica (iPSC) — Duboko uranjanje u znanost i budući potencijal
- Uvod u pomlađivanje iPSC-a i epigenetsku modulaciju
- CRISPR-Cas9: Mehanizmi i inovacije u epigenetskom uređivanju
- Ključni epigenetski ciljevi za pomlađivanje iPSC-a
- Nedavni napredci: Studije slučaja i eksperimentalni rezultati
- Izazovi i ograničenja u epigenetskoj modulaciji CRISPR-Cas9
- Terapeutske implikacije i primjene regenerativne medicine
- Etička razmatranja i regulatorni okvir
- Budući smjerovi: Emergentne tehnologije i istraživačke granice
- Zaključak: Put naprijed za pomlađivanje iPSC-a putem CRISPR-Cas9
- Izvori i reference
Uvod u pomlađivanje iPSC-a i epigenetsku modulaciju
Inducirane pluripotentne matične stanice (iPSCs) su somatske stanice reprogramirane u pluripotentno stanje, što im omogućava da se diferenciraju u različite tipove stanica i nude ogroman potencijal za regenerativnu medicinu i modeliranje bolesti. Međutim, iPSCs često zadržavaju preostalu epigenetsku memoriju iz svojih matičnih stanica, što može ograničiti njihovo potpuno pomlađivanje i potencijal diferencijacije. Epigenetska modulacija — mijenjanje kemijskih modifikacija na DNA ili histonima bez promjene osnovnog genetskog koda — pojavila se kao obećavajuća strategija za poboljšanje pomlađivanja iPSC-a resetiranjem ovih epigenetskih oznaka na stanje koje je više slično embrionalnom.
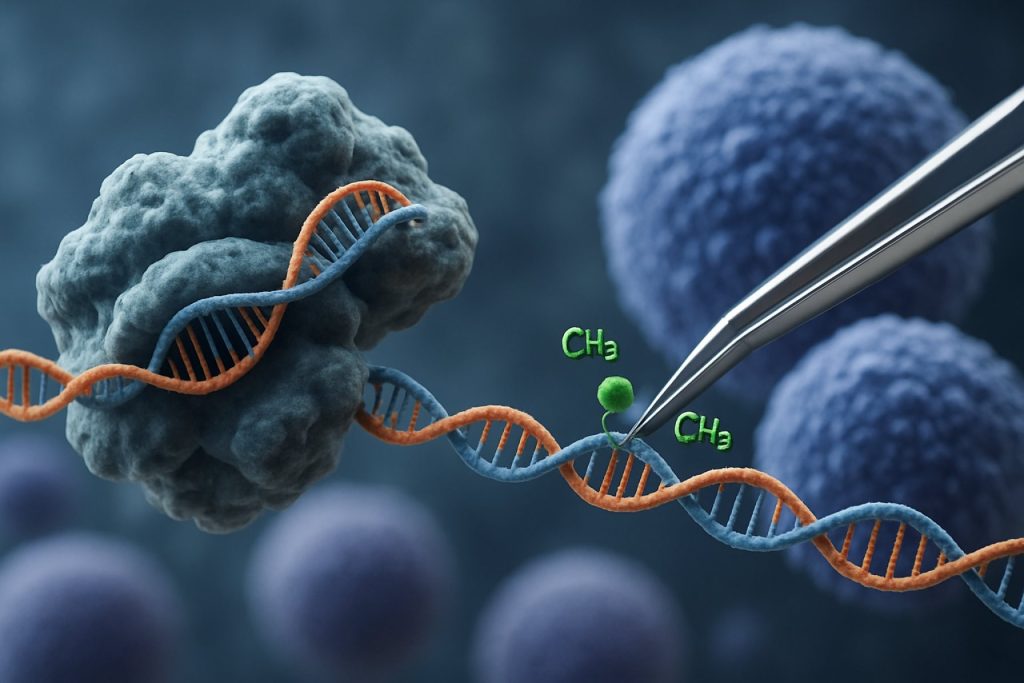
Pojava CRISPR-Cas9 tehnologije revolucionirala je područje epigenetskog uređivanja. Za razliku od tradicionalnih CRISPR aplikacija koje uzrokuju prekide dvostrukih lanaca za uređivanje gena, CRISPR-bazirana epigenetska modulacija koristi katalitički neaktivan Cas9 (dCas9) povezan s epigenetskim efektorskim domenama. Ovaj sustav omogućava preciznu, lokus-specifičnu modifikaciju epigenetskih oznaka, kao što su metilacija DNA ili acetilacija histona, čime omogućava ciljno reprogramiranje profila ekspresije gena u iPSCs. Takve ciljne intervencije mogu izbrisati epigenetske potpise povezane s dobi ili specifične za liniju, potičući potpunije pomlađivanje iPSCs i poboljšavajući njihove funkcionalne osobine.
Nedavne studije pokazale su izvedivost korištenja CRISPR-dCas9 sustava za modulaciju ključnih gena povezanih s pomlađivanjem i epigenetskih regulatora u iPSCs, otvarajući put za učinkovitije i sigurnije terapije matičnim stanicama. Kako se područje razvija, integracija CRISPR-Cas9 epigenetske modulacije s tehnologijom iPSC-a nosi značajnu nadu za prevladavanje trenutnih ograničenja u staničnom reprogramiranju i za razvoj personaliziranih pristupa regenerativnoj medicini (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9: Mehanizmi i inovacije u epigenetskom uređivanju
Sustav CRISPR-Cas9, prvotno razvijen za precizno uređivanje genoma, inovativno je prilagođen za ciljanje epigenetske modulacije, nudeći nove puteve za pomlađivanje induciranih pluripotentnih matičnih stanica (iPSCs). Za razliku od tradicionalnog CRISPR-Cas9, koji uvodi prekide dvostrukih lanaca za uređivanje DNA sekvenci, epigenetsko uređivanje koristi katalitički neaktivan Cas9 (dCas9) povezan s epigenetskim efektorskim domenama. To omogućava lokus-specifičnu modifikaciju stanja kromatina — kao što su metilacija DNA ili acetilacija histona — bez promjene osnovnog genetskog koda. Takva preciznost je ključna za pomlađivanje iPSC-a, gdje resetiranje epigenetskog krajolika može obnoviti mlade profile ekspresije gena i poboljšati staničnu funkciju.
Nedavne inovacije uključuju dCas9 povezan s DNA metiltransferazama ili demetilazama, kao i histonskim acetiltransferazama ili deacetilazama, što omogućava reverzibilnu aktivaciju ili represiju ciljnih gena povezanih s starenjem i senescencijom. Na primjer, ciljana demetilacija promotora za gene pluripotentnosti može reaktivirati njihovu ekspresiju, poboljšavajući kvalitetu iPSC-a i potencijal diferencijacije. Dodatno, demonstrirana je višekratna epigenetska modifikacija — istovremeno ciljanje više lokusa — što dodatno poboljšava proces pomlađivanja orkestrirajući složene mreže regulacije gena Nature Reviews Genetics.
Ovi napreci nadopunjeni su poboljšanim sustavima isporuke, kao što su ribonukleoproteinski kompleksi i virusni vektori, koji povećavaju učinkovitost uređivanja i smanjuju off-target efekte. Zajedno, CRISPR-Cas9-bazirano epigenetsko uređivanje predstavlja transformativni pristup za pomlađivanje iPSC-a, s potencijalom za prevladavanje ograničenja konvencionalnog reprogramiranja i otvaranje puta za regenerativne terapije Cell Stem Cell.
Ključni epigenetski ciljevi za pomlađivanje iPSC-a
Kritični aspekt korištenja CRISPR-Cas9 za epigenetsku modulaciju u pomlađivanju induciranih pluripotentnih matičnih stanica (iPSC) je identifikacija i ciljanje ključnih epigenetskih regulatora koji upravljaju staničnim starenjem i pluripotentnošću. Među najistaknutijim ciljevima su uzorci metilacije DNA, modifikacije histona i lokusi nekodirajuće RNA, koji svi igraju ključne uloge u održavanju ili brisanju stanične memorije tijekom reprogramiranja. Na primjer, status metilacije promotora p16INK4a, poznatog markera senescencije, pokazao je da utječe na proliferativni kapacitet i potencijal pomlađivanja iPSC-a. CRISPR-dCas9 sustavi povezani s DNA demetilazama ili metiltransferazama mogu biti precizno usmjereni na takve lokuse kako bi modifikovali njihovo epigenetsko stanje, čime se povećava učinkovitost reprogramiranja i stanična mladost Nature Reviews Genetics.
Još jedan ključni cilj je regulacija modifikacija histona, kao što su H3K9me3 i H3K27me3, koje su povezane s formiranjem heterohromatina i tišinom gena. Ciljano uređivanje ovih oznaka na specifičnim genetskim regijama korištenjem CRISPR-dCas9 povezanog s enzimima koji modificiraju histone može reaktivirati gene pluripotentnosti ili represirati gene povezane sa starenjem, olakšavajući robusniji proces pomlađivanja Cell Stem Cell. Dodatno, dugi nekodirajući RNAs (lncRNAs) koji modulišu arhitekturu kromatina i ekspresiju gena pojavljuju se kao obećavajući CRISPR ciljevi za fino podešavanje epigenetskog krajolika iPSC-a Nature Cell Biology.
Sveukupno, strateška selekcija i precizna modulacija ovih epigenetskih ciljeva korištenjem CRISPR-Cas9-baziranih alata nosi značajnu nadu za napredovanje pomlađivanja iPSC-a i razvoj regenerativnih terapija.
Nedavni napredci: Studije slučaja i eksperimentalni rezultati
Nedavne godine svjedočile su značajnom napretku u korištenju CRISPR-Cas9-bazirane epigenetske modulacije za pomlađivanje induciranih pluripotentnih matičnih stanica (iPSCs). Značajno, nekoliko studija je pokazalo izvedivost korištenja katalitički neaktivnog Cas9 (dCas9) povezanog s epigenetskim modifikatorima za ciljanje i remodeliranje specifičnih kromatinskih regija, čime se preokreću epigenetske oznake povezane s dobi u iPSCs. Na primjer, značajna studija Nature izvijestila je o korištenju dCas9-TET1 za demetilaciju promotorskih regija ključnih gena pluripotentnosti, što je rezultiralo poboljšanom učinkovitošću reprogramiranja i poboljšanim markerima pomlađivanja stanica.
Još jedan ključni eksperiment objavljen od strane Cell Stem Cell koristio je dCas9-p300 za acetilaciju histona H3K27 na lokusima povezanim s mladalačkim profilima ekspresije gena. Ovo ciljno epigenetsko uređivanje ne samo da je obnovilo mlade transkripcijske potpise, već je također poboljšalo mitohondrijsku funkciju i smanjilo fenotipove povezane sa senescencijom u iPSCs izvedenim od starijih donora.
Štoviše, nedavna predklinička studija od strane Science pokazala je da bi višekratno CRISPR-dCas9 epigenetsko uređivanje moglo istovremeno modulirati više staza povezanih sa starenjem, što dovodi do sinergističkih efekata na pomlađivanje iPSC-a. Ovi nalazi zajedno naglašavaju potencijal CRISPR-Cas9 epigenetske modulacije kao preciznog i svestranog alata za preokret staničnog starenja u iPSCs, otvarajući put za buduće translacijske primjene u regenerativnoj medicini i modeliranju bolesti povezanih sa starenjem.
Izazovi i ograničenja u epigenetskoj modulaciji CRISPR-Cas9
Unatoč transformativnom potencijalu CRISPR-Cas9-bazirane epigenetske modulacije u pomlađivanju induciranih pluripotentnih matičnih stanica (iPSCs), nekoliko izazova i ograničenja i dalje postoji. Jedna od glavnih zabrinutosti su off-target efekti, gdje se CRISPR-Cas9 sustav može nenamjerno vezati za i modificirati nepredviđene genomske lokuse, što može dovesti do nepredvidivih epigenetskih promjena i genomske nestabilnosti. Ovo je posebno kritično u kontekstu pomlađivanja iPSC-a, jer čak i manje off-target modifikacije mogu kompromitirati pluripotentnost ili pokrenuti onkogene staze Nature Reviews Genetics.
Još jedno ograničenje leži u učinkovitosti i specifičnosti epigenetskog uređivanja. Iako katalitički neaktivan Cas9 (dCas9) povezan s epigenetskim modifikatorima može ciljati specifične lokuse, stupanj i trajnost epigenetskih promjena — kao što su metilacija DNA ili modifikacija histona — često su varijabilni i možda neće u potpunosti ponoviti mladi epigenetski krajolik potreban za robusno pomlađivanje iPSC-a Cell Stem Cell. Dodatno, isporuka CRISPR-dCas9 komponenti u iPSCs ostaje tehnički izazovna, pri čemu virusni vektori predstavljaju rizike od umetničke mutageneze, a nevirusne metode često pate od niske učinkovitosti.
Imunogenost je još jedna zabrinutost, jer uvođenje egzogenih proteina kao što je Cas9 može izazvati imunološke odgovore, posebno u kliničkim primjenama. Nadalje, dugoročna stabilnost i sigurnost epigenetski modificiranih iPSCs još uvijek nisu u potpunosti utvrđene, što postavlja pitanja o njihovoj prikladnosti za terapijsku upotrebu U.S. Food & Drug Administration. Rješavanje ovih izazova je ključno za sigurnu i učinkovitu primjenu strategija epigenetske modulacije CRISPR-Cas9 u pomlađivanju iPSC-a.
Terapeutske implikacije i primjene regenerativne medicine
Primjena CRISPR-Cas9-bazirane epigenetske modulacije u pomlađivanju induciranih pluripotentnih matičnih stanica (iPSC) nosi značajan potencijal za terapeutske intervencije i regenerativnu medicinu. Preciznim ciljanjem i modificiranjem epigenetskih oznaka — kao što su metilacija DNA i modifikacije histona — na specifičnim genetskim lokusima, istraživači mogu preokrenuti epigenetske promjene povezane s dobi u iPSCs, čime se poboljšava njihova pluripotentnost, genomska stabilnost i potencijal diferencijacije. Ovaj proces pomlađivanja je ključan za generiranje visokokvalitetnih iPSCs pogodnih za terapije zamjene stanica, modeliranje bolesti i testiranje lijekova.
U regenerativnoj medicini, pomlađeni iPSCs mogu se diferencirati u različite tipove stanica s poboljšanom funkcionalnošću i smanjenim rizikom od senescencije ili tumorigenosti, rješavajući glavne sigurnosne brige u kliničkim primjenama. Na primjer, epigenetsko uređivanje gena uključenih u stanično starenje, kao što su p16INK4a ili TERT, može obnoviti mlade profile ekspresije gena i duljinu telomera, povećavajući terapeutski učinak izvedenih stanica. Osim toga, CRISPR-dCas9 fuzijski proteini vezani uz epigenetske modifikatore omogućuju reverzibilnu i lokus-specifičnu modulaciju, minimizirajući off-target efekte i trajne genomske promjene, što je ključno za kliničku primjenu Nature Reviews Genetics.
Sposobnost pomlađivanja iPSCs izvedenih od pacijenata također otvara putove za personalizirane regenerativne terapije, gdje se autologne stanice mogu pomladiti, ispraviti za mutacije koje uzrokuju bolesti i diferencirati u funkcionalna tkiva za transplantaciju. Ovaj pristup ima potencijal za liječenje širokog spektra degenerativnih bolesti, uključujući neurodegenerativne poremećaje, kardiovaskularne bolesti i dijabetes, pružajući obnovljiv izvor mladih, pacijent-specifičnih stanica Cell Stem Cell. Kako tehnologija napreduje, integracija CRISPR-Cas9 epigenetske modulacije s terapijama temeljenim na iPSC-u mogla bi revolucionirati krajolik regenerativne medicine.
Etička razmatranja i regulatorni okvir
Primjena epigenetske modulacije posredovane CRISPR-Cas9 u pomlađivanju induciranih pluripotentnih matičnih stanica (iPSC) predstavlja značajne etičke i regulatorne izazove. Za razliku od tradicionalnog uređivanja gena, epigenetska modulacija ne mijenja DNA sekvencu, već umjesto toga modificira ekspresiju gena kroz reverzibilne promjene, kao što su metilacija DNA ili modifikacija histona. Iako to može smanjiti neke zabrinutosti povezane s trajnim genetskim promjenama, dugoročni učinci i potencijal za off-target utjecaje ostaju neizvjesni, postavljajući pitanja o sigurnosti i nepredviđenim posljedicama u kliničkim primjenama.
Etički, korištenje CRISPR-Cas9 u pomlađivanju iPSC-a preklapa se s raspravama o ljudskom poboljšanju, pristanku i potencijalu za prijenos na germinalne stanice ako se pomlađene stanice koriste u reproduktivnim kontekstima. Također postoji zabrinutost oko ravnotežnog pristupa takvim naprednim terapijama, što bi moglo pogoršati postojeće zdravstvene nejednakosti. Mogućnost stvaranja “dizajnerskih” stanica ili tkiva dodatno komplicira etički krajolik, zahtijevajući robusnu kontrolu i angažman javnosti.
Regulatorni okviri za CRISPR-bazirane epigenetske intervencije još uvijek se razvijaju. U Sjedinjenim Američkim Državama, U.S. Food and Drug Administration nadzire terapije genskim i stanicama temeljenim proizvodima, ali specifične smjernice za epigenetsko uređivanje su u razvoju. Europska agencija za lijekove također regulira proizvode napredne terapije, uključujući one koji uključuju uređivanje genoma i epigenoma. Na međunarodnoj razini, organizacije kao što su Svjetska zdravstvena organizacija pozvale su na globalne standarde i upravljanje kako bi se riješili jedinstveni rizici i etičke dileme koje postavljaju ove tehnologije.
Kako istraživanje napreduje, kontinuirani dijalog među znanstvenicima, etičarima, regulatorima i javnošću bit će ključan za osiguranje odgovorne inovacije i sigurnog, pravednog primjenjivanja CRISPR-Cas9 epigenetske modulacije u pomlađivanju iPSC-a.
Budući smjerovi: Emergentne tehnologije i istraživačke granice
Budućnost CRISPR-Cas9 epigenetske modulacije u pomlađivanju induciranih pluripotentnih matičnih stanica (iPSC) spremna je za značajne napretke, potaknuta emergentnim tehnologijama i novim istraživačkim granicama. Jedan obećavajući smjer je integracija CRISPR-baziranog epigenetskog uređivanja s multi-omikama na razini pojedinačnih stanica, omogućavajući precizno mapiranje i manipulaciju stanjima kromatina, metilacijom DNA i modifikacijama histona na razini pojedinačne stanice. Ovaj pristup mogao bi razjasniti heterogenost populacija iPSC-a i optimizirati protokole pomlađivanja za poboljšanu staničnu funkciju i dugovječnost Nature Reviews Genetics.
Još jedna granica uključuje razvoj sustava CRISPR nove generacije, kao što su bazni uređivači i primarni uređivači, koji omogućuju rafiniranije i reverzibilne epigenetske modifikacije bez uvođenja prekida dvostrukih lanaca. Ovi alati mogu minimizirati off-target efekte i genomske nestabilnosti, rješavajući ključne sigurnosne brige u kliničkim primjenama Cell Stem Cell. Osim toga, korištenje programabilnih epigenetskih efektora, kao što je dCas9 povezan s enzimima koji modificiraju kromatin, istražuje se za resetiranje epigenetskih oznaka povezanih s dobi i obnavljanje mladih profila ekspresije gena u iPSCs Science.
Gledajući unaprijed, očekuje se da će konvergencija umjetne inteligencije i strojnog učenja s CRISPR tehnologijama ubrzati identifikaciju ciljeva za pomlađivanje i predvidjeti optimalne strategije uređivanja. Nadalje, napredak u sustavima isporuke, kao što su metode temeljene na nanopartiklima ili bez virusa, poboljšat će učinkovitost i sigurnost epigenetskog uređivanja u iPSCs. Zajedno, ove inovacije imaju potencijal revolucionirati regenerativnu medicinu i modeliranje bolesti povezanih sa starenjem omogućavajući precizno, sigurno i trajno pomlađivanje iPSC-a Nature Biotechnology.
Zaključak: Put naprijed za pomlađivanje iPSC-a putem CRISPR-Cas9
Primjena epigenetske modulacije posredovane CRISPR-Cas9 u pomlađivanju induciranih pluripotentnih matičnih stanica (iPSCs) predstavlja transformativnu granicu u regenerativnoj medicini. Omogućujući precizno, lokus-specifično uređivanje epigenetskih oznaka, ova tehnologija nudi potencijal za resetiranje molekularnih potpisa povezanih s dobi, poboljšanje kvalitete iPSC-a i povećanje njihove terapeutske korisnosti. Nedavni napreci pokazali su izvedivost ciljanje ključnih epigenetskih regulatora za obnavljanje mladih profila ekspresije gena i funkcionalnih kapaciteta u iPSCs, čime se rješavaju ograničenja poput preostale epigenetske memorije i nepotpunog reprogramiranja Nature Reviews Genetics.
Gledajući unaprijed, nekoliko izazova i prilika definira put prema kliničkoj primjeni. Osiguranje specifičnosti i sigurnosti CRISPR-baziranog epigenetskog uređivanja ostaje od najveće važnosti, jer off-target efekti i nepredviđene promjene kromatina mogu kompromitirati funkciju stanica ili sigurnost U.S. Food & Drug Administration. Razvoj alata CRISPR nove generacije s poboljšanom točnošću, kao i robusni sustavi isporuke, bit će ključni za napredovanje ovog područja. Nadalje, integracija multi-omik pristupa za praćenje i validaciju ishoda pomlađivanja poboljšat će naše razumijevanje osnovnih mehanizama i olakšati regulatorno odobrenje National Human Genome Research Institute.
Na kraju, konvergencija CRISPR-Cas9 tehnologije i biologije iPSC-a nosi ogroman potencijal za personalizirane terapije stanicama, modeliranje bolesti i proučavanje ljudskog starenja. Kontinuirana interdisciplinarna suradnja i etički nadzor bit će ključni za ostvarenje punog terapeutski potencijala pomlađivanja iPSC-a putem epigenetske modulacije.