Hoe CRISPR-Cas9 Epigenetische Modulatie de Verjonging van Geïnduceerde Pluripotente Stamcellen (iPSC) Revolutioneert—Een Diepgaande Verkenning van de Wetenschap en Toekomstige Potentieel
- Inleiding tot iPSC Verjonging en Epigenetische Modulatie
- CRISPR-Cas9: Mechanismen en Innovaties in Epigenetische Bewerking
- Belangrijke Epigenetische Doelen voor iPSC Verjonging
- Recente Vooruitgangen: Casestudy’s en Experimentele Resultaten
- Uitdagingen en Beperkingen in CRISPR-Cas9 Epigenetische Modulatie
- Therapeutische Implicaties en Toepassingen in de Regeneratieve Geneeskunde
- Ethische Overwegingen en Regelgevende Landschap
- Toekomstige Richtingen: Opkomende Technologieën en Onderzoeksgrenzen
- Conclusie: De Weg Vooruit voor iPSC Verjonging via CRISPR-Cas9
- Bronnen & Referenties
Inleiding tot iPSC Verjonging en Epigenetische Modulatie
Geïnduceerde pluripotente stamcellen (iPSCs) zijn somatische cellen die zijn gereprogrammeerd naar een pluripotente staat, waardoor ze zich kunnen differentiëren in verschillende celtypen en enorme potentieel bieden voor regeneratieve geneeskunde en ziekte-modellering. Echter, iPSCs behouden vaak residuele epigenetische herinneringen van hun oorspronkelijke cellen, wat hun volledige verjonging en differentiatie potentieel kan beperken. Epigenetische modulatie—het veranderen van chemische modificaties op DNA of histonen zonder de onderliggende genetische code te veranderen—is naar voren gekomen als een veelbelovende strategie om iPSC-verjonging te verbeteren door deze epigenetische merken terug te zetten naar een meer embryonale staat.
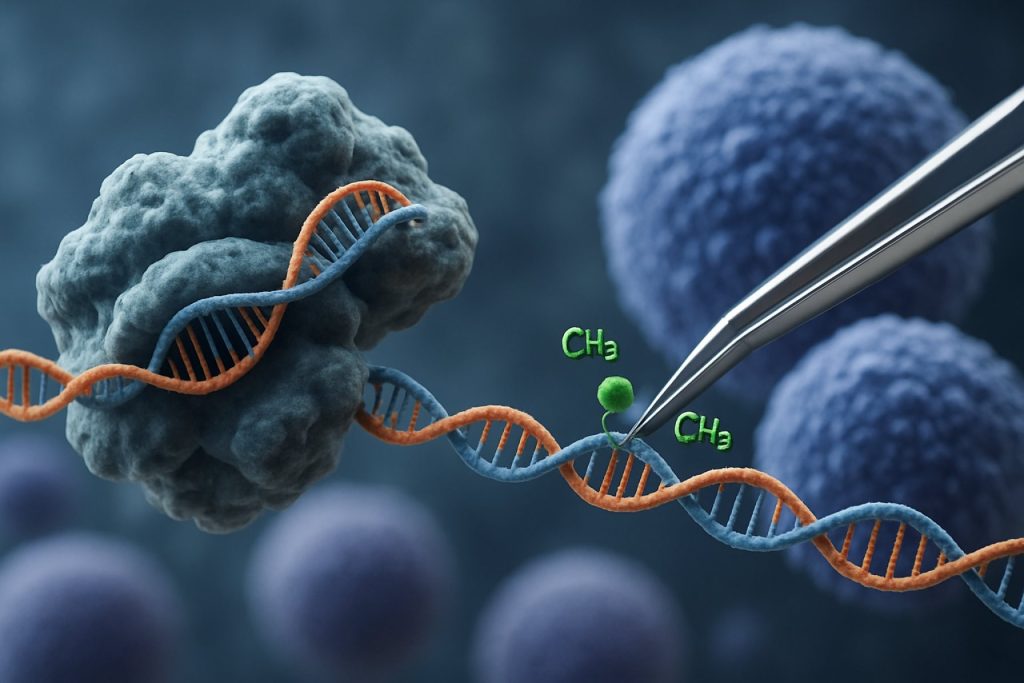
De opkomst van CRISPR-Cas9-technologie heeft het veld van epigenetische bewerking revolutionair veranderd. In tegenstelling tot traditionele CRISPR-toepassingen die dubbele-streng breuken induceren voor genbewerking, maakt CRISPR-gebaseerde epigenetische modulatie gebruik van catalytisch inactieve Cas9 (dCas9) die is gefuseerd met epigenetische effectordomeinen. Dit systeem maakt nauwkeurige, locus-specifieke modificatie van epigenetische merken mogelijk, zoals DNA-methylering of histon-acetylatie, waardoor gerichte herschikking van genexpressieprofielen in iPSCs mogelijk is. Dergelijke gerichte interventies kunnen leeftijdsgebonden of lijnspecifieke epigenetische handtekeningen wissen, wat een meer complete verjonging van iPSCs bevordert en hun functionele eigenschappen verbetert.
Recente studies hebben de haalbaarheid aangetoond van het gebruik van CRISPR-dCas9-systemen om belangrijke verjongingsgerelateerde genen en epigenetische regulatoren in iPSCs te moduleren, wat de weg vrijmaakt voor efficiëntere en veiligere stamceltherapieën. Naarmate het veld vordert, houdt de integratie van CRISPR-Cas9 epigenetische modulatie met iPSC-technologie aanzienlijke belofte in voor het overwinnen van huidige beperkingen in cellulaire herprogrammering en voor de ontwikkeling van gepersonaliseerde regeneratieve geneeskunde benaderingen (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9: Mechanismen en Innovaties in Epigenetische Bewerking
Het CRISPR-Cas9-systeem, oorspronkelijk ontwikkeld voor nauwkeurige genbewerking, is innovatief aangepast voor gerichte epigenetische modulatie, wat nieuwe mogelijkheden biedt voor de verjonging van geïnduceerde pluripotente stamcellen (iPSCs). In tegenstelling tot traditionele CRISPR-Cas9, die dubbele-streng breuken introduceert om DNA-sequenties te bewerken, maakt epigenetische bewerking gebruik van een catalytisch inactieve Cas9 (dCas9) die is gefuseerd met epigenetische effectordomeinen. Dit maakt locus-specifieke modificatie van chromatine toestanden—zoals DNA-methylering of histon-acetylatie—mogelijk zonder de onderliggende genetische code te veranderen. Een dergelijke precisie is cruciaal voor iPSC-verjonging, waar het resetten van het epigenetische landschap de jeugdige genexpressieprofielen kan herstellen en de cellulaire functie kan verbeteren.
Recente innovaties omvatten dCas9 gefuseerd met DNA-methyltransferasen of demethylasen, evenals histon-acetyltransferasen of deacetylasen, waardoor de omkeerbare activatie of repressie van doelgenen die betrokken zijn bij veroudering en senescentie mogelijk is. Bijvoorbeeld, gerichte demethylering van promoters voor pluripotentiegenen kan hun expressie reactiveren, wat de kwaliteit en differentiatiepotentieel van iPSCs verbetert. Bovendien is multiplexed epigenetische bewerking—het gelijktijdig targeten van meerdere loci—gedemonstreerd, wat het verjongingsproces verder verbetert door complexe genregulerende netwerken te orkestreren Nature Reviews Genetics.
Deze vooruitgangen worden aangevuld door verbeterde leveringssystemen, zoals ribonucleoproteïnecomplexen en virale vectoren, die de bewerkings efficiëntie verhogen en off-target effecten verminderen. Gecombineerd vertegenwoordigt CRISPR-Cas9-gebaseerde epigenetische bewerking een transformerende benadering voor iPSC-verjonging, met het potentieel om de beperkingen van conventionele herprogrammering te overwinnen en de weg te effenen voor regeneratieve therapieën Cell Stem Cell.
Belangrijke Epigenetische Doelen voor iPSC Verjonging
Een kritisch aspect van het benutten van CRISPR-Cas9 voor epigenetische modulatie in de verjonging van geïnduceerde pluripotente stamcellen (iPSCs) is de identificatie en targeting van belangrijke epigenetische regulatoren die de cellulaire veroudering en pluripotentie beheersen. Onder de meest prominente doelen zijn DNA-methyleringspatronen, histonmodificaties en niet-coderende RNA-loci, die allemaal een cruciale rol spelen in het handhaven of wissen van cellulaire herinneringen tijdens herprogrammering. Bijvoorbeeld, de methyleringsstatus van de p16INK4a promoter, een bekende senescentiemarker, heeft invloed op de proliferatieve capaciteit en verjongingspotentieel van iPSCs aangetoond. CRISPR-dCas9-systemen gefuseerd met DNA-demethylasen of methyltransferasen kunnen nauwkeurig op dergelijke loci worden gericht om hun epigenetische staat te moduleren, waardoor de herprogrammeringsefficiëntie en cellulaire jeugdigheid worden verbeterd Nature Reviews Genetics.
Een ander belangrijk doel is de regulatie van histonmodificaties, zoals H3K9me3 en H3K27me3, die geassocieerd zijn met heterochromatinevorming en gen-silencing. Gerichte bewerking van deze merken op specifieke genoomregio’s met behulp van CRISPR-dCas9 gefuseerd met histon-modificerende enzymen kan pluripotentiegenen reactiveren of verouderingsgerelateerde genen onderdrukken, wat een robuuster verjongingsproces vergemakkelijkt Cell Stem Cell. Bovendien komen lange niet-coderende RNA’s (lncRNA’s) die de chromatinestructuur en genexpressie moduleren, naar voren als veelbelovende CRISPR-doelen voor het fijn afstemmen van het epigenetische landschap van iPSCs Nature Cell Biology.
Over het algemeen houdt de strategische selectie en nauwkeurige modulatie van deze epigenetische doelen met behulp van CRISPR-Cas9-gebaseerde tools aanzienlijke belofte in voor het bevorderen van iPSC-verjonging en de ontwikkeling van regeneratieve therapieën.
Recente Vooruitgangen: Casestudy’s en Experimentele Resultaten
De afgelopen jaren hebben aanzienlijke vooruitgang geboekt in het benutten van CRISPR-Cas9-gebaseerde epigenetische modulatie om geïnduceerde pluripotente stamcellen (iPSCs) te verjongen. Opmerkelijk is dat verschillende studies de haalbaarheid hebben aangetoond van het gebruik van catalytisch inactieve Cas9 (dCas9) gefuseerd met epigenetische modificatoren om specifieke chromatinegebieden te targeten en te herstructureren, waardoor leeftijdsgebonden epigenetische merken in iPSCs worden teruggedraaid. Bijvoorbeeld, een baanbrekende studie door Nature meldde het gebruik van dCas9-TET1 om de promoterregio’s van belangrijke pluripotentiegenen te demethyleren, wat resulteerde in verbeterde herprogrammeringsefficiëntie en verbeterde cellulaire verjongingsmarkers.
Een ander cruciaal experiment gepubliceerd door Cell Stem Cell gebruikte dCas9-p300 om histon H3K27 te acetylateren op loci die geassocieerd zijn met jeugdige genexpressieprofielen. Deze gerichte epigenetische bewerking herstelde niet alleen jeugdige transcriptiehandtekeningen, maar verbeterde ook de mitochondriale functie en verminderde senescentie-geassocieerde fenotypes in iPSCs afgeleid van oudere donoren.
Bovendien toonde een recente preklinische studie door Science aan dat multiplexed CRISPR-dCas9 epigenetische bewerking meerdere verouderingsgerelateerde paden tegelijkertijd kon moduleren, wat leidde tot synergetische effecten op iPSC-verjonging. Deze bevindingen benadrukken gezamenlijk het potentieel van CRISPR-Cas9 epigenetische modulatie als een precisie- en veelzijdig hulpmiddel voor het omkeren van cellulaire veroudering in iPSCs, wat de weg vrijmaakt voor toekomstige translationele toepassingen in regeneratieve geneeskunde en ziekte-modellering gerelateerd aan veroudering.
Uitdagingen en Beperkingen in CRISPR-Cas9 Epigenetische Modulatie
Ondanks het transformerende potentieel van CRISPR-Cas9-gebaseerde epigenetische modulatie in het verjongen van geïnduceerde pluripotente stamcellen (iPSCs), blijven verschillende uitdagingen en beperkingen bestaan. Een grote zorg zijn off-target effecten, waarbij het CRISPR-Cas9-systeem per ongeluk kan binden aan en ongewenste genoomloci kan modificeren, wat mogelijk leidt tot onvoorspelbare epigenetische veranderingen en genoominstabiliteit. Dit is bijzonder kritisch in de context van iPSC-verjonging, aangezien zelfs kleine off-target modificaties de pluripotentie kunnen compromitteren of oncogene paden kunnen activeren Nature Reviews Genetics.
Een andere beperking ligt in de efficiëntie en specificiteit van epigenetische bewerking. Hoewel catalytisch dode Cas9 (dCas9) gefuseerd met epigenetische modificatoren specifieke loci kan targeten, zijn de mate en persistentie van epigenetische veranderingen—zoals DNA-methylering of histonmodificatie—vaak variabel en kunnen ze de jeugdige epigenetische landschap die nodig is voor robuuste iPSC-verjonging niet volledig repliceren Cell Stem Cell. Bovendien blijft de levering van CRISPR-dCas9-componenten in iPSCs technisch uitdagend, waarbij virale vectoren risico’s van insertie-mutagenese met zich meebrengen en niet-virale methoden vaak lijden onder lage efficiëntie.
Immunogeniciteit is een andere zorg, aangezien de introductie van exogene eiwitten zoals Cas9 immuunreacties kan oproepen, vooral in klinische toepassingen. Bovendien zijn de langetermijnstabiliteit en veiligheid van epigenetisch gemodificeerde iPSCs nog niet volledig vastgesteld, wat vragen oproept over hun geschiktheid voor therapeutisch gebruik U.S. Food & Drug Administration. Het aanpakken van deze uitdagingen is essentieel voor de veilige en effectieve vertaling van CRISPR-Cas9 epigenetische modulatiestrategieën in iPSC-verjonging.
Therapeutische Implicaties en Toepassingen in de Regeneratieve Geneeskunde
De toepassing van CRISPR-Cas9-gebaseerde epigenetische modulatie in de verjonging van geïnduceerde pluripotente stamcellen (iPSCs) houdt aanzienlijke belofte in voor therapeutische interventies en regeneratieve geneeskunde. Door epigenetische merken—zoals DNA-methylering en histonmodificaties—nauwkeurig te targeten en te modificeren op specifieke genoomloci, kunnen onderzoekers leeftijdsgebonden epigenetische veranderingen in iPSCs terugdraaien, waardoor hun pluripotentie, genoomstabiliteit en differentiatiepotentieel worden verbeterd. Dit verjongingsproces is cruciaal voor het genereren van hoogwaardige iPSCs die geschikt zijn voor celvervangende therapieën, ziekte-modellering en medicijnscreening.
In de regeneratieve geneeskunde kunnen verjongde iPSCs worden gedifferentieerd in verschillende celtypen met verbeterde functionaliteit en een verminderd risico op senescentie of tumorigeniteit, wat belangrijke veiligheidszorgen in klinische toepassingen aanpakt. Bijvoorbeeld, epigenetische bewerking van genen die betrokken zijn bij cellulaire veroudering, zoals p16INK4a of TERT, kan jeugdige genexpressieprofielen en telomeerlengte herstellen, wat de therapeutische effectiviteit van afgeleide cellen verbetert. Bovendien stellen CRISPR-dCas9-fusie-eiwitten die aan epigenetische modificatoren zijn gehecht omkeerbare en locus-specifieke modulatie mogelijk, waardoor off-target effecten en permanente genoomveranderingen worden geminimaliseerd, wat cruciaal is voor klinische vertaling Nature Reviews Genetics.
De mogelijkheid om patiënt-afgeleide iPSCs te verjongen opent ook mogelijkheden voor gepersonaliseerde regeneratieve therapieën, waarbij autologe cellen kunnen worden verjongd, gecorrigeerd voor ziekteveroorzakende mutaties en gedifferentieerd in functionele weefsels voor transplantatie. Deze benadering heeft het potentieel om een breed scala aan degeneratieve ziekten te behandelen, waaronder neurodegeneratieve aandoeningen, hart- en vaatziekten en diabetes, door een hernieuwbare bron van jeugdige, patiënt-specifieke cellen te bieden Cell Stem Cell. Naarmate de technologie vordert, zou de integratie van CRISPR-Cas9 epigenetische modulatie met iPSC-gebaseerde therapieën het landschap van regeneratieve geneeskunde kunnen revolutioneren.
Ethische Overwegingen en Regelgevende Landschap
De toepassing van CRISPR-Cas9-gemediëerde epigenetische modulatie in de verjonging van geïnduceerde pluripotente stamcellen (iPSCs) presenteert aanzienlijke ethische en regelgevende uitdagingen. In tegenstelling tot traditionele genbewerking, verandert epigenetische modulatie de DNA-sequentie niet, maar wijzigt in plaats daarvan de genexpressie door omkeerbare veranderingen, zoals DNA-methylering of histonmodificatie. Hoewel dit sommige zorgen over permanente genetische veranderingen kan verminderen, blijven de langetermijneffecten en het potentieel voor off-target impact onzeker, wat vragen oproept over veiligheid en onbedoelde gevolgen in klinische toepassingen.
Ethisch gezien kruist het gebruik van CRISPR-Cas9 in iPSC-verjonging met debatten over menselijke verbetering, toestemming en het potentieel voor germinale overdracht als verjongde cellen in reproductieve contexten worden gebruikt. Er is ook bezorgdheid over gelijke toegang tot dergelijke geavanceerde therapieën, die bestaande gezondheidsverschillen kunnen verergeren. De mogelijkheid om “designer” cellen of weefsels te creëren, compliceert het ethische landschap verder, wat robuuste toezicht en publieke betrokkenheid vereist.
Regelgevende kaders voor CRISPR-gebaseerde epigenetische interventies zijn nog steeds in ontwikkeling. In de Verenigde Staten houdt de U.S. Food and Drug Administration toezicht op gentherapie en celgebaseerde producten, maar specifieke richtlijnen voor epigenetische bewerking zijn in ontwikkeling. De European Medicines Agency reguleert eveneens geavanceerde therapie geneeskundige producten, inclusief die welke betrokken zijn bij genoom- en epigenoom-bewerking. Internationaal hebben organisaties zoals de World Health Organization opgeroepen tot wereldwijde normen en governance om de unieke risico’s en ethische dilemma’s die door deze technologieën worden gepresenteerd aan te pakken.
Naarmate het onderzoek vordert, zal voortdurende dialoog tussen wetenschappers, ethici, regelgevers en het publiek essentieel zijn om verantwoordelijk innoveren en de veilige, eerlijke inzet van CRISPR-Cas9 epigenetische modulatie in iPSC-verjonging te waarborgen.
Toekomstige Richtingen: Opkomende Technologieën en Onderzoeksgrenzen
De toekomst van CRISPR-Cas9 epigenetische modulatie in de verjonging van geïnduceerde pluripotente stamcellen (iPSCs) staat op het punt aanzienlijke vooruitgangen te boeken, aangedreven door opkomende technologieën en nieuwe onderzoeksgrenzen. Een veelbelovende richting is de integratie van CRISPR-gebaseerde epigenetische bewerking met single-cell multi-omics, waardoor nauwkeurige mapping en manipulatie van chromatine toestanden, DNA-methylering en histonmodificaties op het niveau van individuele cellen mogelijk is. Deze benadering zou de heterogeniteit van iPSC-populaties kunnen ontrafelen en verjongingsprotocollen kunnen optimaliseren voor verbeterde cellulaire functie en levensduur Nature Reviews Genetics.
Een andere grens betreft de ontwikkeling van next-generation CRISPR-systemen, zoals base editors en prime editors, die verfijndere en omkeerbare epigenetische modificaties mogelijk maken zonder dubbele-streng breuken in te voeren. Deze tools kunnen off-target effecten en genoominstabiliteit minimaliseren, wat belangrijke veiligheidszorgen in klinische toepassingen aanpakt Cell Stem Cell. Bovendien wordt het gebruik van programmeerbare epigenetische effectors, zoals dCas9 gefuseerd met chromatine-modificerende enzymen, onderzocht om leeftijdsgebonden epigenetische merken te resetten en jeugdige genexpressieprofielen in iPSCs te herstellen Science.
Als we vooruitkijken, wordt verwacht dat de convergentie van kunstmatige intelligentie en machine learning met CRISPR-technologieën de identificatie van verjongingsdoelen zal versnellen en optimale bewerkingsstrategieën zal voorspellen. Bovendien zullen vooruitgangen in leveringssystemen, zoals nanopartikel-gebaseerde of virusvrije methoden, de efficiëntie en veiligheid van epigenetische bewerking in iPSCs verbeteren. Gecombineerd hebben deze innovaties het potentieel om regeneratieve geneeskunde en ziekte-modellering gerelateerd aan veroudering te revolutioneren door nauwkeurige, veilige en duurzame iPSC-verjonging mogelijk te maken Nature Biotechnology.
Conclusie: De Weg Vooruit voor iPSC Verjonging via CRISPR-Cas9
De toepassing van CRISPR-Cas9-gemediëerde epigenetische modulatie in de verjonging van geïnduceerde pluripotente stamcellen (iPSCs) vertegenwoordigt een transformerende grens in de regeneratieve geneeskunde. Door nauwkeurige, locus-specifieke bewerking van epigenetische merken mogelijk te maken, biedt deze technologie het potentieel om leeftijdsgebonden moleculaire handtekeningen te resetten, de kwaliteit van iPSCs te verbeteren en hun therapeutische nut te vergroten. Recente vooruitgangen hebben de haalbaarheid aangetoond van het targeten van belangrijke epigenetische regulatoren om jeugdige genexpressieprofielen en functionele capaciteiten in iPSCs te herstellen, waardoor beperkingen zoals residuele epigenetische herinnering en onvolledige herprogrammering worden aangepakt Nature Reviews Genetics.
Als we vooruitkijken, definiëren verschillende uitdagingen en kansen de weg naar klinische vertaling. Het waarborgen van de specificiteit en veiligheid van CRISPR-gebaseerde epigenetische bewerking blijft van het grootste belang, aangezien off-target effecten en onbedoelde chromatinale veranderingen de cel functie of veiligheid kunnen compromitteren U.S. Food & Drug Administration. De ontwikkeling van next-generation CRISPR-tools met verbeterde nauwkeurigheid, evenals robuuste leveringssystemen, zal cruciaal zijn voor de vooruitgang van dit veld. Bovendien zal de integratie van multi-omics benaderingen om verjongingsresultaten te monitoren en te valideren ons begrip van de onderliggende mechanismen verbeteren en de goedkeuring door regelgevers vergemakkelijken National Human Genome Research Institute.
Uiteindelijk houdt de convergentie van CRISPR-Cas9-technologie en iPSC-biologie enorme belofte in voor gepersonaliseerde celtherapieën, ziekte-modellering en de studie van menselijke veroudering. Voortdurende interdisciplinair samenwerking en ethische toezicht zullen essentieel zijn om het volledige therapeutische potentieel van iPSC-verjonging via epigenetische modulatie te realiseren.