Как эпигенетическая модификация CRISPR-Cas9 революционизирует омоложение индуцированных плюрипотентных стволовых клеток (iPSC) — глубокое погружение в науку и будущее потенциала
- Введение в омоложение iPSC и эпигенетическую модификацию
- CRISPR-Cas9: механизмы и инновации в эпигенетическом редактировании
- Ключевые эпигенетические мишени для омоложения iPSC
- Недавние достижения: примеры и экспериментальные результаты
- Проблемы и ограничения эпигенетической модификации CRISPR-Cas9
- Терапевтические последствия и приложения в регенеративной медицине
- Этические соображения и нормативная среда
- Будущие направления: новые технологии и исследовательские границы
- Заключение: Путь вперед для омоложения iPSC с помощью CRISPR-Cas9
- Источники и ссылки
Введение в омоложение iPSC и эпигенетическую модификацию
Индуцированные плюрипотентные стволовые клетки (iPSC) — это соматические клетки, перепрограммированные в плюрипотентное состояние, что позволяет им дифференцироваться в различные типы клеток и предлагает огромный потенциал для регенеративной медицины и моделирования заболеваний. Однако iPSC часто сохраняют остаточную эпигенетическую память от своих исходных клеток, что может ограничивать их полное омоложение и потенциал дифференцировки. Эпигенетическая модификация — изменение химических модификаций на ДНК или гистонах без изменения основного генетического кода — стала многообещающей стратегией для улучшения омоложения iPSC путем сброса этих эпигенетических меток в более эмбрионоподобное состояние.
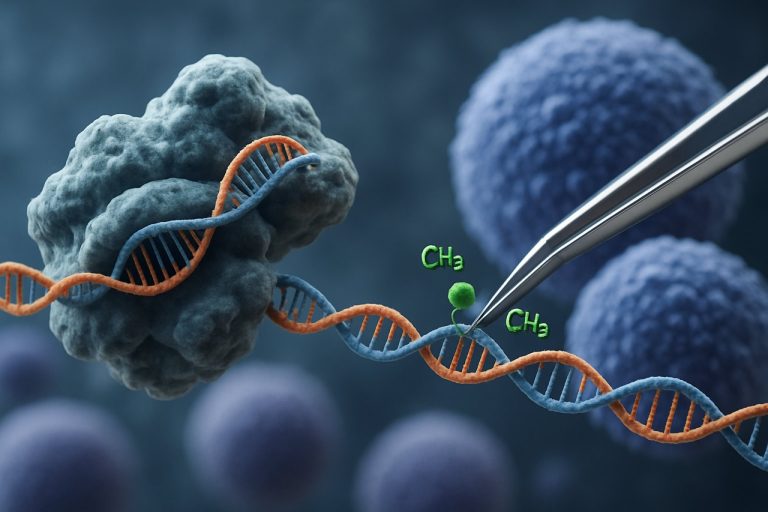
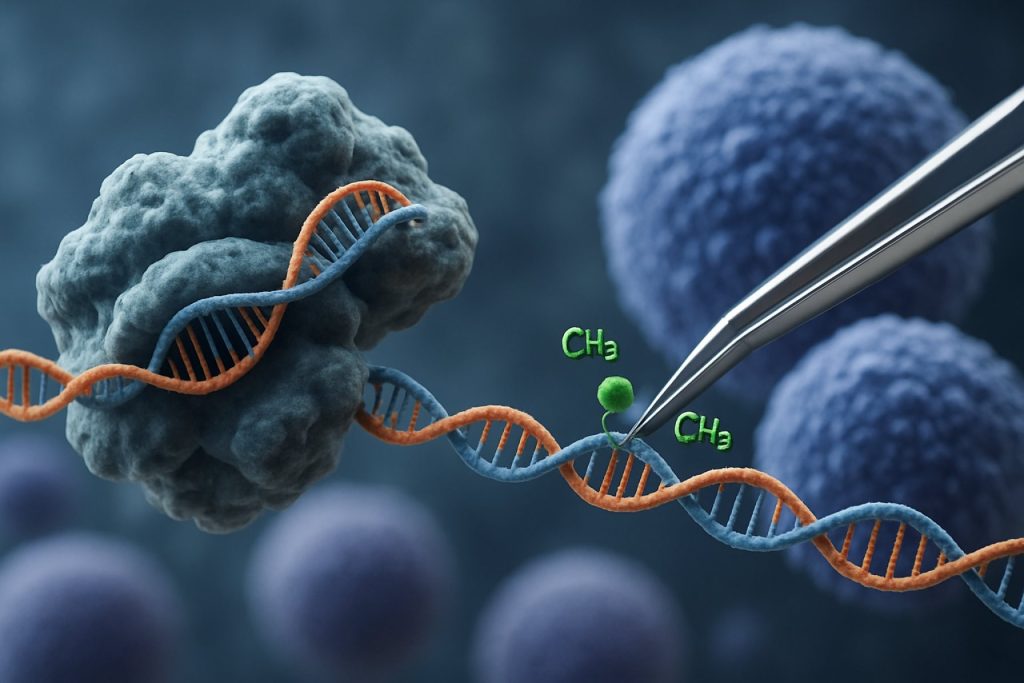
Появление технологии CRISPR-Cas9 революционизировало область эпигенетического редактирования. В отличие от традиционных приложений CRISPR, которые вызывают разрывы обеих цепей для редактирования генов, основанная на CRISPR эпигенетическая модификация использует катализатор Cas9 (dCas9), который не активен и соединен с эпигенетическими эффектными доменами. Эта система позволяет точно модифицировать эпигенетические метки, такие как метилирование ДНК или ацетилирование гистонов, тем самым позволяя целенаправленное перепрограммирование профилей экспрессии генов в iPSC. Такие целенаправленные вмешательства могут стереть эпигенетические сигнатуры, связанные с возрастом или специфичностью линии, способствуя более полному омоложению iPSC и улучшая их функциональные свойства.
Недавние исследования продемонстрировали возможность использования систем CRISPR-dCas9 для модификации ключевых генов, связанных с омоложением, и эпигенетических регуляторов в iPSC, открывая путь к более эффективным и безопасным стволовым клеточным терапиям. По мере развития этой области интеграция эпигенетической модификации CRISPR-Cas9 с технологией iPSC имеет значительный потенциал для преодоления текущих ограничений в клеточной перепрограммировке и разработки персонализированных подходов в регенеративной медицине (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9: механизмы и инновации в эпигенетическом редактировании
Система CRISPR-Cas9, изначально разработанная для точного редактирования генома, была инновационно адаптирована для целенаправленной эпигенетической модификации, предлагая новые пути для омоложения индуцированных плюрипотентных стволовых клеток (iPSC). В отличие от традиционного CRISPR-Cas9, который вводит разрывы обеих цепей для редактирования последовательностей ДНК, эпигенетическое редактирование использует катализатор Cas9 (dCas9), который не активен и соединен с эпигенетическими эффектными доменами. Это позволяет модифицировать состояния хроматина на конкретных локусах — таких как метилирование ДНК или ацетилирование гистонов — без изменения основного генетического кода. Такая точность имеет решающее значение для омоложения iPSC, где сброс эпигенетического ландшафта может восстановить молодые профили экспрессии генов и улучшить клеточную функцию.
Недавние инновации включают dCas9, соединенный с метилтрансферазами или деметилазами ДНК, а также с ацетилтрансферазами или деацетилазами гистонов, что позволяет обратимо активировать или подавлять целевые гены, связанные с старением и старением клеток. Например, целенаправленное деметилирование промоторов генов плюрипотентности может реактивировать их экспрессию, улучшая качество iPSC и потенциал дифференцировки. Кроме того, было продемонстрировано многократное эпигенетическое редактирование — одновременное нацеливание на несколько локусов — что дополнительно улучшает процесс омоложения, координируя сложные генетические регуляторные сети Nature Reviews Genetics.
Эти достижения дополняются улучшенными системами доставки, такими как рибонуклеопротеиновые комплексы и вирусные векторы, которые увеличивают эффективность редактирования и уменьшают эффекты вне цели. В совокупности эпигенетическое редактирование на основе CRISPR-Cas9 представляет собой трансформационный подход к омоложению iPSC, с потенциалом преодолеть ограничения традиционной перепрограммировки и проложить путь для регенеративных терапий Cell Stem Cell.
Ключевые эпигенетические мишени для омоложения iPSC
Критическим аспектом использования CRISPR-Cas9 для эпигенетической модификации в омоложении индуцированных плюрипотентных стволовых клеток (iPSC) является идентификация и нацеливание на ключевые эпигенетические регуляторы, которые управляют клеточным старением и плюрипотентностью. Среди наиболее значимых мишеней — паттерны метилирования ДНК, модификации гистонов и локусы некодирующих РНК, которые играют ключевую роль в поддержании или стирании клеточной памяти во время перепрограммировки. Например, статус метилирования промотора p16INK4a, хорошо известного маркера старения, был показан как влияющий на пролиферативную способность и потенциал омоложения iPSC. Системы CRISPR-dCas9, соединенные с деметилазами или метилтрансферазами ДНК, могут быть точно направлены на такие локусы для модификации их эпигенетического состояния, тем самым повышая эффективность перепрограммировки и клеточную молодость Nature Reviews Genetics.
Еще одной ключевой мишенью является регуляция модификаций гистонов, таких как H3K9me3 и H3K27me3, которые связаны с образованием гетерохроматина и подавлением генов. Целенаправленное редактирование этих меток в специфических геномных областях с использованием CRISPR-dCas9, соединенного с ферментами, модифицирующими гистоны, может реактивировать гены плюрипотентности или подавлять гены, связанные со старением, способствуя более мощному процессу омоложения Cell Stem Cell. Кроме того, длинные некодирующие РНК (lncRNA), которые модифицируют архитектуру хроматина и экспрессию генов, становятся многообещающими целями для CRISPR, позволяя точно настраивать эпигенетический ландшафт iPSC Nature Cell Biology.
В целом, стратегический выбор и точная модификация этих эпигенетических мишеней с использованием инструментов на основе CRISPR-Cas9 имеют значительный потенциал для продвижения омоложения iPSC и разработки регенеративных терапий.
Недавние достижения: примеры и экспериментальные результаты
В последние годы были достигнуты значительные успехи в использовании эпигенетической модификации на основе CRISPR-Cas9 для омоложения индуцированных плюрипотентных стволовых клеток (iPSC). В частности, несколько исследований продемонстрировали возможность использования катализатора Cas9 (dCas9), соединенного с эпигенетическими модификаторами, для нацеливания и перестройки конкретных хроматиновых регионов, тем самым обращая вспять эпигенетические метки, связанные с возрастом, в iPSC. Например, знаковое исследование, проведенное Nature, сообщило о применении dCas9-TET1 для деметилирования промоторных регионов ключевых генов плюрипотентности, что привело к повышению эффективности перепрограммирования и улучшению маркеров клеточного омоложения.
Еще один важный эксперимент, опубликованный в Cell Stem Cell, использовал dCas9-p300 для ацетилирования гистона H3K27 в локусах, связанных с молодыми профилями экспрессии генов. Это целенаправленное эпигенетическое редактирование не только восстановило молодые транскрипционные сигнатуры, но и улучшило митохондриальную функцию и снизило фенотипы, связанные со старением, в iPSC, полученных от пожилых доноров.
Кроме того, недавнее доклиническое исследование, проведенное в Science, продемонстрировало, что многократное эпигенетическое редактирование CRISPR-dCas9 может одновременно модифицировать несколько связанных со старением путей, что приводит к синергетическим эффектам на омоложение iPSC. Эти результаты в совокупности подчеркивают потенциал эпигенетической модификации CRISPR-Cas9 как точного и универсального инструмента для обращения вспять клеточного старения в iPSC, прокладывая путь для будущих трансляционных приложений в регенеративной медицине и моделировании заболеваний, связанных со старением.
Проблемы и ограничения эпигенетической модификации CRISPR-Cas9
Несмотря на трансформационный потенциал эпигенетической модификации на основе CRISPR-Cas9 в омоложении индуцированных плюрипотентных стволовых клеток (iPSC), существуют несколько проблем и ограничений. Одной из основных проблем являются эффекты вне цели, когда система CRISPR-Cas9 может непреднамеренно связываться с и модифицировать непреднамеренные геномные локусы, что может привести к непредсказуемым эпигенетическим изменениям и геномной нестабильности. Это особенно критично в контексте омоложения iPSC, так как даже незначительные модификации вне цели могут нарушить плюрипотентность или запустить онкогенные пути Nature Reviews Genetics.
Еще одно ограничение связано с эффективностью и специфичностью эпигенетического редактирования. Хотя катализатор Cas9 (dCas9), соединенный с эпигенетическими модификаторами, может нацеливаться на специфические локусы, степень и устойчивость эпигенетических изменений — таких как метилирование ДНК или модификация гистонов — часто являются переменными и могут не полностью воссоздать молодой эпигенетический ландшафт, необходимый для надежного омоложения iPSC Cell Stem Cell. Кроме того, доставка компонентов CRISPR-dCas9 в iPSC остается технически сложной, при этом вирусные векторы представляют собой риски инсерционной мутагенезы, а не вирусные методы часто страдают от низкой эффективности.
Иммуногенность также является проблемой, так как введение экзогенных белков, таких как Cas9, может вызывать иммунный ответ, особенно в клинических приложениях. Более того, долгосрочная стабильность и безопасность эпигенетически модифицированных iPSC еще не были полностью установлены, что вызывает вопросы о их пригодности для терапевтического использования U.S. Food & Drug Administration. Решение этих проблем имеет важное значение для безопасного и эффективного применения стратегий эпигенетической модификации CRISPR-Cas9 в омоложении iPSC.
Терапевтические последствия и приложения в регенеративной медицине
Применение эпигенетической модификации на основе CRISPR-Cas9 в омоложении индуцированных плюрипотентных стволовых клеток (iPSC) имеет значительный потенциал для терапевтических вмешательств и регенеративной медицины. Точно нацеливаясь и модифицируя эпигенетические метки — такие как метилирование ДНК и модификации гистонов — в специфических геномных локусах, исследователи могут обратить вспять изменения, связанные с возрастом, в iPSC, тем самым повышая их плюрипотентность, геномную стабильность и потенциал дифференцировки. Этот процесс омоложения критически важен для генерации высококачественных iPSC, подходящих для клеточных заменительных терапий, моделирования заболеваний и скрининга лекарств.
В регенеративной медицине омоложенные iPSC могут быть дифференцированы в различные типы клеток с улучшенной функциональностью и сниженным риском старения или опухолевой способности, что решает основные проблемы безопасности в клинических приложениях. Например, эпигенетическое редактирование генов, связанных с клеточным старением, таких как p16INK4a или TERT, может восстановить молодые профили экспрессии генов и длину теломер, повышая терапевтическую эффективность производных клеток. Более того, белки слияния CRISPR-dCas9, связанные с эпигенетическими модификаторами, позволяют обратимую и локус-специфическую модификацию, минимизируя эффекты вне цели и постоянные геномные изменения, что критически важно для клинического применения Nature Reviews Genetics.
Способность омолаживать iPSC, полученные от пациентов, также открывает возможности для персонализированных регенеративных терапий, где аутологичные клетки могут быть омоложены, исправлены от мутаций, вызывающих заболевания, и дифференцированы в функциональные ткани для трансплантации. Этот подход имеет потенциал для лечения широкого спектра дегенеративных заболеваний, включая нейродегенеративные расстройства, сердечно-сосудистые заболевания и диабет, предоставляя возобновляемый источник молодых, специфических для пациента клеток Cell Stem Cell. По мере развития технологии интеграция эпигенетической модификации CRISPR-Cas9 с терапиями на основе iPSC может революционизировать ландшафт регенеративной медицины.
Этические соображения и нормативная среда
Применение эпигенетической модификации, опосредованной CRISPR-Cas9, в омоложении индуцированных плюрипотентных стволовых клеток (iPSC) представляет собой значительные этические и нормативные вызовы. В отличие от традиционного редактирования генов, эпигенетическая модификация не изменяет последовательность ДНК, а вместо этого модифицирует экспрессию генов через обратимые изменения, такие как метилирование ДНК или модификация гистонов. Хотя это может снизить некоторые опасения, связанные с постоянными генетическими изменениями, долгосрочные эффекты и потенциал внецельных воздействий остаются неопределенными, что поднимает вопросы о безопасности и непреднамеренных последствиях в клинических приложениях.
Этически использование CRISPR-Cas9 в омоложении iPSC пересекается с дискуссиями о человеческом улучшении, согласии и потенциале передачи по зародышевой линии, если омоложенные клетки используются в репродуктивных контекстах. Существуют также опасения по поводу равного доступа к таким передовым терапиям, которые могут усугубить существующие различия в здоровье. Возможность создания «дизайнерских» клеток или тканей еще больше усложняет этический ландшафт, требуя надежного контроля и общественного участия.
Нормативные рамки для эпигенетических вмешательств на основе CRISPR все еще находятся в процессе разработки. В Соединенных Штатах Управление по контролю за продуктами и лекарствами США контролирует генные терапии и клеточные продукты, но конкретные руководящие принципы для эпигенетического редактирования находятся в стадии разработки. Европейское агентство по лекарственным средствам аналогично регулирует продукты медицинских терапий продвинутого типа, включая те, которые связаны с редактированием генома и эпигенома. На международном уровне такие организации, как Всемирная организация здравоохранения, призвали к созданию глобальных стандартов и управления, чтобы решить уникальные риски и этические дилеммы, возникающие из этих технологий.
По мере продвижения исследований продолжающийся диалог между учеными, этиками, регуляторами и обществом будет необходим для обеспечения ответственной инновации и безопасного, справедливого применения эпигенетической модификации CRISPR-Cas9 в омоложении iPSC.
Будущие направления: новые технологии и исследовательские границы
Будущее эпигенетической модификации CRISPR-Cas9 в омоложении индуцированных плюрипотентных стволовых клеток (iPSC) готово к значительным достижениям, движимым новыми технологиями и новыми исследовательскими границами. Одним из многообещающих направлений является интеграция эпигенетического редактирования на основе CRISPR с многомасштабным анализом на уровне отдельных клеток, что позволяет точно картировать и манипулировать состояниями хроматина, метилированием ДНК и модификациями гистонов на уровне отдельных клеток. Этот подход может раскрыть гетерогенность популяций iPSC и оптимизировать протоколы омоложения для улучшения клеточной функции и долголетия Nature Reviews Genetics.
Еще одной границей является разработка систем CRISPR следующего поколения, таких как базовые редакторы и первичные редакторы, которые позволяют более тонкие и обратимые эпигенетические модификации без введения разрывов обеих цепей. Эти инструменты могут минимизировать эффекты вне цели и геномную нестабильность, решая ключевые проблемы безопасности в клинических приложениях Cell Stem Cell. Кроме того, использование программируемых эпигенетических эффекторов, таких как dCas9, соединенный с ферментами, модифицирующими хроматин, исследуется для сброса эпигенетических меток, связанных с возрастом, и восстановления молодых профилей экспрессии генов в iPSC Science.
Смотря в будущее, ожидается, что слияние искусственного интеллекта и машинного обучения с технологиями CRISPR ускорит идентификацию целей омоложения и предскажет оптимальные стратегии редактирования. Более того, достижения в системах доставки, таких как методы на основе наночастиц или безвирусные методы, повысят эффективность и безопасность эпигенетического редактирования в iPSC. В совокупности эти инновации имеют потенциал революционизировать регенеративную медицину и моделирование заболеваний, связанных со старением, позволяя точно, безопасно и долговременно омолаживать iPSC Nature Biotechnology.
Заключение: Путь вперед для омоложения iPSC с помощью CRISPR-Cas9
Применение эпигенетической модификации, опосредованной CRISPR-Cas9, в омоложении индуцированных плюрипотентных стволовых клеток (iPSC) представляет собой трансформационную границу в регенеративной медицине. Позволяя точное, локус-специфическое редактирование эпигенетических меток, эта технология предлагает потенциал для сброса молекулярных сигнатур, связанных с возрастом, повышения качества iPSC и улучшения их терапевтической полезности. Недавние достижения продемонстрировали возможность нацеливания на ключевые эпигенетические регуляторы для восстановления молодых профилей экспрессии генов и функциональных способностей в iPSC, тем самым решая ограничения, такие как остаточная эпигенетическая память и неполная перепрограммировка Nature Reviews Genetics.
Смотря вперед, несколько проблем и возможностей определяют путь к клиническому применению. Обеспечение специфичности и безопасности редактирования на основе CRISPR остается первоочередной задачей, так как эффекты вне цели и непреднамеренные изменения хроматина могут поставить под угрозу функцию клеток или безопасность U.S. Food & Drug Administration. Разработка инструментов CRISPR следующего поколения с улучшенной точностью, а также надежных систем доставки будет критически важной для продвижения этой области. Более того, интеграция многомасштабных подходов для мониторинга и проверки результатов омоложения улучшит наше понимание основных механизмов и облегчит получение регуляторного одобрения National Human Genome Research Institute.
В конечном счете, слияние технологии CRISPR-Cas9 и биологии iPSC имеет огромный потенциал для персонализированных клеточных терапий, моделирования заболеваний и изучения человеческого старения. Продолжение междисциплинарного сотрудничества и этического контроля будет необходимым для реализации полного терапевтического потенциала омоложения iPSC с помощью эпигенетической модификации.
Источники и ссылки
- Nature Reviews Genetics
- Европейское агентство по лекарственным средствам
- Всемирная организация здравоохранения