CRISPR-Cas9 Epigenetik Modülasyonunun İndüklenmiş Pluripotent Kök Hücre (iPSC) Yenilenmesini Nasıl Devrim Yarattığı—Bilim ve Gelecek Potansiyeline Derin Bir Bakış
- iPSC Yenilenmesi ve Epigenetik Modülasyona Giriş
- CRISPR-Cas9: Epigenetik Düzenlemedeki Mekanizmalar ve Yenilikler
- iPSC Yenilenmesi için Anahtar Epigenetik Hedefler
- Son Gelişmeler: Vaka Çalışmaları ve Deneysel Sonuçlar
- CRISPR-Cas9 Epigenetik Modülasyondaki Zorluklar ve Sınırlamalar
- Terapötik Etkiler ve Yenileyici Tıp Uygulamaları
- Etik Hususlar ve Düzenleyici Manzara
- Gelecek Yönelimleri: Yeni Teknolojiler ve Araştırma Sınırları
- Sonuç: CRISPR-Cas9 ile iPSC Yenilenmesi İçin İlerideki Yol
- Kaynaklar & Referanslar
iPSC Yenilenmesi ve Epigenetik Modülasyona Giriş
İndüklenmiş pluripotent kök hücreler (iPSC’ler), çeşitli hücre türlerine farklılaşma yeteneği sağlayan pluripotent bir duruma yeniden programlanmış somatik hücrelerdir ve yenileyici tıp ve hastalık modelleme için büyük bir potansiyel sunar. Ancak, iPSC’ler genellikle köken aldıkları hücrelerden kalan epigenetik hafızayı korur, bu da tam yenilenme ve farklılaşma potansiyellerini sınırlayabilir. Epigenetik modülasyon—DNA veya histonlar üzerindeki kimyasal değişiklikleri, temel genetik kodu değiştirmeden değiştirme—bu epigenetik işaretleri daha embriyonik benzeri bir duruma sıfırlayarak iPSC yenilenmesini artırmak için umut verici bir strateji olarak ortaya çıkmıştır.
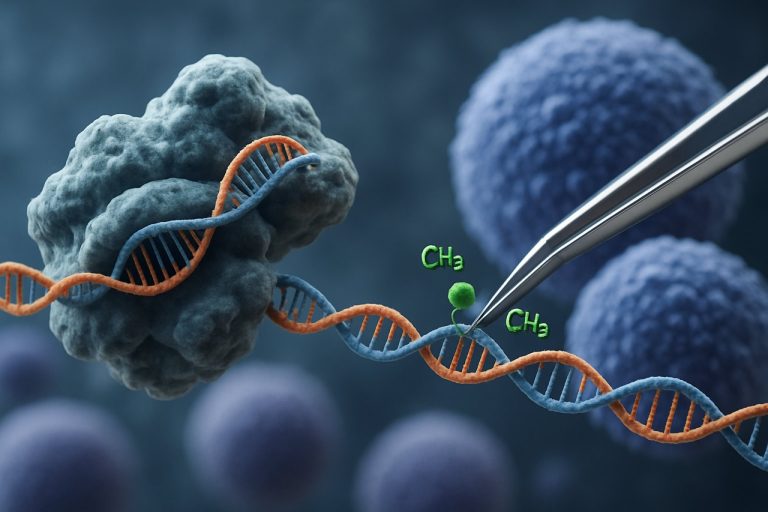
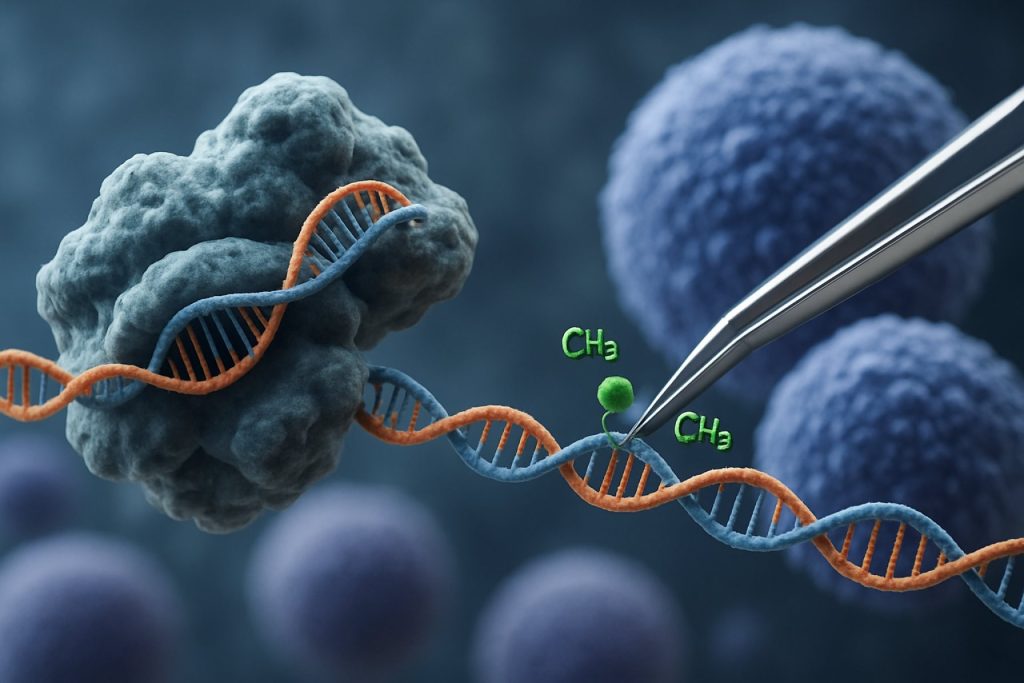
CRISPR-Cas9 teknolojisinin ortaya çıkışı, epigenetik düzenleme alanında devrim yaratmıştır. Geleneksel CRISPR uygulamalarının gen düzenleme için çift sarmal kırılmalar oluşturduğu yerlerde, CRISPR tabanlı epigenetik modülasyon, epigenetik etkileyici alanlara bağlı olarak katalitik olarak inaktif Cas9 (dCas9) kullanmaktadır. Bu sistem, DNA metilasyonu veya histon asetilasyonu gibi epigenetik işaretlerin hassas, lokus-spesifik modifikasyonunu sağlar ve böylece iPSC’lerde gen ekspresyon profillerinin hedefli yeniden programlanmasını mümkün kılar. Bu tür hedefli müdahaleler, yaşa bağlı veya soy spesifik epigenetik imzaları silerek iPSC’lerin daha tam bir yenilenmesini teşvik edebilir ve fonksiyonel özelliklerini iyileştirebilir.
Son çalışmalar, CRISPR-dCas9 sistemlerinin iPSC’lerde anahtar yenilenme ile ilişkili genleri ve epigenetik düzenleyicileri modüle etme olasılığını göstermiştir ve bu, daha etkili ve güvenli kök hücre tedavileri için bir yol açmaktadır. Alan ilerledikçe, CRISPR-Cas9 epigenetik modülasyonunun iPSC teknolojisi ile entegrasyonu, hücresel yeniden programlamadaki mevcut sınırlamaların üstesinden gelmek ve kişiselleştirilmiş yenileyici tıp yaklaşımlarının geliştirilmesi için önemli bir umut taşımaktadır (Nature Reviews Genetics, Cell Stem Cell).
CRISPR-Cas9: Epigenetik Düzenlemedeki Mekanizmalar ve Yenilikler
CRISPR-Cas9 sistemi, başlangıçta hassas genom düzenleme için geliştirilmiş olup, hedefli epigenetik modülasyon için yenilikçi bir şekilde uyarlanmıştır ve bu, indüklenmiş pluripotent kök hücrelerin (iPSC’ler) yenilenmesi için yeni yollar sunmaktadır. Geleneksel CRISPR-Cas9’un DNA dizilerini düzenlemek için çift sarmal kırılmalar oluşturduğu yerlerde, epigenetik düzenleme, epigenetik etkileyici alanlara bağlı olarak katalitik olarak inaktif Cas9 (dCas9) kullanmaktadır. Bu, temel genetik kodu değiştirmeden kromatin durumlarının—örneğin DNA metilasyonu veya histon asetilasyonu—lokus-spesifik modifikasyonunu sağlar. Bu tür bir hassasiyet, iPSC yenilenmesi için kritik öneme sahiptir; çünkü epigenetik manzarayı sıfırlamak, genç gen ekspresyon profillerini geri kazandırabilir ve hücresel işlevi artırabilir.
Son yenilikler, yaşlanma ve yaşlanma ile ilişkili genlerde hedefli aktivasyon veya baskılamayı sağlayan DNA metiltransferazlar veya demetilazlar ile histon asetiltransferazlar veya deasetilazlar ile birleştirilmiş dCas9’u içermektedir. Örneğin, pluripotentlik genlerinin promotörlerinin hedefli demetilasyonu, bu genlerin ifadesini yeniden aktive edebilir ve iPSC kalitesini ve farklılaşma potansiyelini artırabilir. Ayrıca, çoklu epigenetik düzenleme—birden fazla lokusu aynı anda hedefleme—geliştirilmiş olup, karmaşık gen düzenleyici ağları düzenleyerek yenilenme sürecini daha da artırmaktadır Nature Reviews Genetics.
Bu ilerlemeler, düzenleme verimliliğini artıran ve hedef dışı etkileri azaltan ribonükleoprotein kompleksleri ve viral vektörler gibi geliştirilmiş taşıma sistemleri ile desteklenmektedir. Toplu olarak, CRISPR-Cas9 tabanlı epigenetik düzenleme, iPSC yenilenmesi için dönüştürücü bir yaklaşım sunmakta ve geleneksel yeniden programlamanın sınırlamalarını aşma potansiyeline sahip olmaktadır ve yenileyici tedavilere zemin hazırlamaktadır Cell Stem Cell.
iPSC Yenilenmesi için Anahtar Epigenetik Hedefler
İndüklenmiş pluripotent kök hücre (iPSC) yenilenmesinde CRISPR-Cas9’u kullanmanın kritik bir yönü, hücresel yaşlanmayı ve pluripotentliği yöneten anahtar epigenetik düzenleyicilerin tanımlanması ve hedeflenmesidir. En belirgin hedefler arasında DNA metilasyon kalıpları, histon modifikasyonları ve kodlamayan RNA lokusları bulunmaktadır; bunların hepsi yeniden programlama sırasında hücresel hafızayı sürdürmede veya silmede önemli roller oynamaktadır. Örneğin, iyi bilinen bir yaşlanma belirteci olan p16INK4a promotörünün metilasyon durumu, iPSC’lerin proliferatif kapasitesini ve yenilenme potansiyelini etkilediği gösterilmiştir. DNA demetilazlar veya metiltransferazlar ile birleştirilmiş CRISPR-dCas9 sistemleri, bu tür lokuslara hassas bir şekilde yönlendirilebilir ve epigenetik durumlarını modüle ederek yeniden programlama verimliliğini ve hücresel gençliği artırabilir Nature Reviews Genetics.
Bir diğer önemli hedef, heterokromatin oluşumu ve gen susturma ile ilişkili H3K9me3 ve H3K27me3 gibi histon modifikasyonlarının düzenlenmesidir. CRISPR-dCas9’u histon modifiye edici enzimlerle birleştirerek bu işaretlerin belirli genom bölgelerinde hedefli düzenlenmesi, pluripotentlik genlerini yeniden aktive edebilir veya yaşlanma ile ilişkili genleri baskılayabilir ve daha güçlü bir yenilenme sürecini kolaylaştırabilir Cell Stem Cell. Ayrıca, kromatin mimarisini ve gen ekspresyonunu modüle eden uzun kodlamayan RNA’lar (lncRNA’lar), iPSC’lerin epigenetik manzarasını ince ayar yapmak için umut verici CRISPR hedefleri olarak ortaya çıkmaktadır Nature Cell Biology.
Genel olarak, bu epigenetik hedeflerin stratejik seçimi ve CRISPR-Cas9 tabanlı araçlar kullanılarak hassas modülasyonu, iPSC yenilenmesini ilerletmek ve yenileyici tedavilerin geliştirilmesi için önemli bir umut taşımaktadır.
Son Gelişmeler: Vaka Çalışmaları ve Deneysel Sonuçlar
Son yıllarda, CRISPR-Cas9 tabanlı epigenetik modülasyonu kullanarak indüklenmiş pluripotent kök hücreleri (iPSC’leri) yenileme konusunda önemli ilerlemeler kaydedilmiştir. Özellikle, birkaç çalışma, belirli kromatin bölgelerini hedefleyip yeniden şekillendirmek için epigenetik modifikatörlerle birleştirilmiş katalitik olarak inaktif Cas9 (dCas9) kullanmanın uygulanabilirliğini göstermiştir ve böylece iPSC’lerde yaşa bağlı epigenetik işaretleri tersine çevirmiştir. Örneğin, Nature dergisinde yayınlanan bir öncü çalışma, anahtar pluripotentlik genlerinin promotör bölgelerini demetilasyon için dCas9-TET1 kullanımını bildirmiştir ve bu, yeniden programlama verimliliğini artırmış ve hücresel yenilenme belirteçlerini geliştirmiştir.
Cell Stem Cell dergisinde yayınlanan bir diğer önemli deney, genç gen ekspresyon profilleri ile ilişkili lokuslarda histon H3K27’yi asetileştirmek için dCas9-p300 kullanmıştır. Bu hedefli epigenetik düzenleme, sadece genç transkripsiyon imzalarını geri kazandırmakla kalmamış, aynı zamanda yaşlı bağışıklardan elde edilen iPSC’lerde mitokondriyal fonksiyonu iyileştirmiş ve yaşlanma ile ilişkili fenotipleri azaltmıştır.
Ayrıca, Science dergisinde yayınlanan son bir ön klinik çalışma, çoklu CRISPR-dCas9 epigenetik düzenlemenin yaşlanma ile ilişkili birden fazla yolu aynı anda modüle edebileceğini göstererek, iPSC yenilenmesi üzerinde sinerjik etkilere yol açmıştır. Bu bulgular, CRISPR-Cas9 epigenetik modülasyonunun, iPSC’lerde hücresel yaşlanmayı tersine çevirmek için hassas ve çok yönlü bir araç olarak potansiyelini vurgulamaktadır ve yenileyici tıp ile yaşa bağlı hastalık modelleme alanında gelecekteki uygulamalara zemin hazırlamaktadır.
CRISPR-Cas9 Epigenetik Modülasyondaki Zorluklar ve Sınırlamalar
İndüklenmiş pluripotent kök hücreleri (iPSC’leri) yenilemede CRISPR-Cas9 tabanlı epigenetik modülasyonun dönüştürücü potansiyeline rağmen, birkaç zorluk ve sınırlama devam etmektedir. Önemli bir endişe, hedef dışı etkiler olup, CRISPR-Cas9 sistemi istemeden istenmeyen genom lokuslarına bağlanıp değiştirebilir ve bu da öngörülemeyen epigenetik değişikliklere ve genomik istikrarsızlığa yol açabilir. Bu, iPSC yenilenmesi bağlamında özellikle kritiktir; çünkü hedef dışı küçük modifikasyonlar bile pluripotentliği tehlikeye atabilir veya onkogenik yolları tetikleyebilir Nature Reviews Genetics.
Bir diğer sınırlama, epigenetik düzenlemenin verimliliği ve özgüllüğüdür. Epigenetik modifikatörlerle birleştirilmiş katalitik olarak ölü Cas9 (dCas9) belirli lokusları hedefleyebilse de, epigenetik değişikliklerin—örneğin DNA metilasyonu veya histon modifikasyonu—derecesi ve kalıcılığı genellikle değişkendir ve iPSC yenilenmesi için gerekli genç epigenetik manzarayı tam olarak yeniden oluşturamayabilir Cell Stem Cell. Ayrıca, CRISPR-dCas9 bileşenlerinin iPSC’lere taşınması teknik olarak zordur ve viral vektörler, ekleme mutajenitesi riskleri taşırken, viral olmayan yöntemler genellikle düşük verimlilikten muzdariptir.
Bağışıklık tepkisi de bir diğer endişe kaynağıdır; çünkü Cas9 gibi dışsal proteinlerin tanıtımı, özellikle klinik uygulamalarda bağışıklık tepkilerini tetikleyebilir. Ayrıca, epigenetik olarak modifiye edilmiş iPSC’lerin uzun vadeli stabilitesi ve güvenliği henüz tam olarak belirlenmemiştir ve bu da terapötik kullanım için uygunlukları hakkında sorular doğurmaktadır U.S. Food & Drug Administration. Bu zorlukların üstesinden gelmek, iPSC yenilenmesinde CRISPR-Cas9 epigenetik modülasyon stratejilerinin güvenli ve etkili bir şekilde çevrilmesi için önemlidir.
Terapötik Etkiler ve Yenileyici Tıp Uygulamaları
İndüklenmiş pluripotent kök hücre (iPSC) yenilenmesinde CRISPR-Cas9 tabanlı epigenetik modülasyonun uygulanması, terapötik müdahaleler ve yenileyici tıp için önemli bir umut taşımaktadır. Araştırmacılar, belirli genom lokuslarında epigenetik işaretleri—örneğin DNA metilasyonu ve histon modifikasyonları—hedefleyerek ve değiştirerek, iPSC’lerde yaşa bağlı epigenetik değişiklikleri tersine çevirebilir ve böylece pluripotentliklerini, genomik stabilitelerini ve farklılaşma potansiyellerini artırabilirler. Bu yenilenme süreci, hücre değiştirme tedavileri, hastalık modelleme ve ilaç taraması için uygun yüksek kaliteli iPSC’ler üretmek için kritik öneme sahiptir.
Yenileyici tıpta, yenilenen iPSC’ler, yaşlanma veya tümör oluşumu riskini azaltarak, geliştirilmiş işlevselliğe sahip çeşitli hücre türlerine farklılaştırılabilir ve klinik uygulamalardaki büyük güvenlik endişelerini ele alabilir. Örneğin, hücresel yaşlanmada yer alan p16INK4a veya TERT gibi genlerin epigenetik düzenlemesi, genç gen ekspresyon profillerini ve telomer uzunluğunu geri kazandırarak türetilen hücrelerin terapötik etkinliğini artırabilir. Dahası, epigenetik modifikatörlerle bağlanan CRISPR-dCas9 füzyon proteinleri, hedef dışı etkileri ve kalıcı genomik değişiklikleri en aza indirerek, klinik çevrim için kritik öneme sahip olan geri dönüşümlü ve lokus-spesifik modülasyon sağlar Nature Reviews Genetics.
Hastadan türetilen iPSC’leri yenileme yeteneği, otolog hücrelerin yenilenmesini, hastalık yapan mutasyonlar için düzeltilmesini ve transplantasyon için işlevsel dokulara farklılaştırılmasını sağladığı için kişiselleştirilmiş yenileyici tedavilere yeni yollar açar. Bu yaklaşım, genç, hasta-spesifik hücrelerin yenilenebilir bir kaynağını sağlayarak, nörodejeneratif bozukluklar, kardiyovasküler hastalıklar ve diyabet gibi geniş bir dejeneratif hastalık yelpazesini tedavi etme potansiyeline sahiptir Cell Stem Cell. Teknoloji olgunlaştıkça, CRISPR-Cas9 epigenetik modülasyonunun iPSC tabanlı tedavilerle entegrasyonu, yenileyici tıbbın manzarasını devrim niteliğinde değiştirebilir.
Etik Hususlar ve Düzenleyici Manzara
İndüklenmiş pluripotent kök hücre (iPSC) yenilenmesinde CRISPR-Cas9 aracılığıyla epigenetik modülasyonun uygulanması, önemli etik ve düzenleyici zorluklar sunmaktadır. Geleneksel gen düzenlemenin aksine, epigenetik modülasyon DNA dizisini değiştirmez, bunun yerine gen ekspresyonunu DNA metilasyonu veya histon modifikasyonu gibi geri dönüşümlü değişikliklerle modifiye eder. Bu, kalıcı genetik değişikliklerle ilişkili bazı endişeleri azaltabilirken, uzun vadeli etkiler ve hedef dışı etkilerin potansiyeli belirsizliğini korumakta ve klinik uygulamalardaki güvenlik ve istenmeyen sonuçlar hakkında sorular doğurmaktadır.
Etik olarak, iPSC yenilenmesinde CRISPR-Cas9’un kullanımı, insan geliştirme, rıza ve yenilenen hücrelerin üreme bağlamlarında kullanılması durumunda germ hattı ile iletim olasılıkları üzerine tartışmalarla kesişmektedir. Ayrıca, bu tür gelişmiş tedavilere eşit erişim konusunda endişeler bulunmaktadır; bu, mevcut sağlık eşitsizliklerini artırabilir. “Tasarım” hücreler veya dokular yaratma olasılığı, etik manzarayı daha da karmaşık hale getirerek sağlam bir denetim ve kamu katılımını gerektirmektedir.
CRISPR tabanlı epigenetik müdahaleler için düzenleyici çerçeveler hala gelişmektedir. Amerika Birleşik Devletleri’nde, U.S. Food and Drug Administration gen tedavisi ve hücre bazlı ürünleri denetler, ancak epigenetik düzenleme için özel yönergeler geliştirilmektedir. Avrupa İlaç Ajansı da, genom ve epigenom düzenlemesini içeren ileri tedavi tıbbi ürünlerini düzenlemektedir. Uluslararası düzeyde, Dünya Sağlık Örgütü gibi kuruluşlar, bu teknolojilerin sunduğu benzersiz riskler ve etik ikilemlerle başa çıkmak için küresel standartlar ve yönetişim çağrısında bulunmuştur.
Araştırmalar ilerledikçe, bilim insanları, etikçiler, düzenleyiciler ve kamu arasında devam eden diyalog, CRISPR-Cas9 epigenetik modülasyonunun iPSC yenilenmesinde sorumlu yenilik ve güvenli, eşit dağıtımını sağlamak için önemli olacaktır.
Gelecek Yönelimleri: Yeni Teknolojiler ve Araştırma Sınırları
İndüklenmiş pluripotent kök hücre (iPSC) yenilenmesinde CRISPR-Cas9 epigenetik modülasyonunun geleceği, yeni teknolojiler ve yenilikçi araştırma sınırları ile önemli ilerlemeler kaydetmeye hazırdır. Bir umut verici yön, CRISPR tabanlı epigenetik düzenlemenin tek hücre çoklu omiklerle entegrasyonu olup, bu, bireysel hücre düzeyinde kromatin durumlarının, DNA metilasyonunun ve histon modifikasyonlarının hassas haritalanmasını ve manipülasyonunu mümkün kılmaktadır. Bu yaklaşım, iPSC popülasyonlarının heterojenliğini çözebilir ve hücresel işlev ve uzunluk için iyileştirilmiş yenilenme protokollerini optimize edebilir Nature Reviews Genetics.
Bir diğer sınır, çift sarmal kırılmalar oluşturmadan daha rafine ve geri dönüşümlü epigenetik modifikasyonlara izin veren yeni nesil CRISPR sistemlerinin geliştirilmesidir. Bu araçlar, hedef dışı etkileri ve genomik istikrarsızlığı en aza indirgeyebilir ve klinik uygulamalardaki güvenlik endişelerini ele alabilir Cell Stem Cell. Ayrıca, yaşa bağlı epigenetik işaretleri sıfırlamak ve iPSC’lerde genç gen ekspresyon profillerini geri kazandırmak için kromatin modifiye edici enzimlerle birleştirilmiş programlanabilir epigenetik etkileyicilerin kullanımı araştırılmaktadır Science.
Gelecekte, yapay zeka ve makine öğreniminin CRISPR teknolojileri ile birleşimi, yenilenme hedeflerinin belirlenmesini hızlandırması ve optimal düzenleme stratejilerini tahmin etmesi beklenmektedir. Ayrıca, nanopartikül bazlı veya virüs içermeyen yöntemler gibi taşıma sistemlerindeki ilerlemeler, iPSC’lerde epigenetik düzenlemenin verimliliğini ve güvenliğini artıracaktır. Toplu olarak, bu yenilikler, hassas, güvenli ve kalıcı iPSC yenilenmesini mümkün kılarak yenileyici tıp ve yaşa bağlı hastalık modellemesini devrim niteliğinde değiştirme potansiyeline sahiptir Nature Biotechnology.
Sonuç: CRISPR-Cas9 ile iPSC Yenilenmesi İçin İlerideki Yol
CRISPR-Cas9 aracılığıyla epigenetik modülasyonun indüklenmiş pluripotent kök hücrelerin (iPSC) yenilenmesindeki uygulanması, yenileyici tıpta dönüştürücü bir sınır temsil etmektedir. Epigenetik işaretlerin hassas, lokus-spesifik düzenlenmesini mümkün kılarak, bu teknoloji, yaşa bağlı moleküler imzaları sıfırlama, iPSC kalitesini artırma ve terapötik faydalarını iyileştirme potansiyeli sunmaktadır. Son gelişmeler, anahtar epigenetik düzenleyicileri hedefleyerek genç gen ekspresyon profillerini ve işlevsel kapasiteleri geri kazandırmanın uygulanabilirliğini göstermiştir ve böylece kalıntı epigenetik hafıza ve eksik yeniden programlama gibi sınırlamaları ele almaktadır Nature Reviews Genetics.
İleride, klinik çevrim yolunu tanımlayan birkaç zorluk ve fırsat bulunmaktadır. CRISPR tabanlı epigenetik düzenlemenin özgüllüğünü ve güvenliğini sağlamak, hedef dışı etkiler ve istenmeyen kromatin değişiklikleri hücre işlevini veya güvenliğini tehlikeye atabileceğinden son derece önemlidir U.S. Food & Drug Administration. İyileştirilmiş doğrulukta yeni nesil CRISPR araçlarının geliştirilmesi ve sağlam taşıma sistemleri, bu alanı ilerletmek için kritik olacaktır. Ayrıca, yenilenme sonuçlarını izlemek ve doğrulamak için çoklu omik yaklaşımlarının entegrasyonu, temel mekanizmaların anlaşılmasını artıracak ve düzenleyici onayı kolaylaştıracaktır National Human Genome Research Institute.
Sonuç olarak, CRISPR-Cas9 teknolojisi ve iPSC biyolojisinin birleşimi, kişiselleştirilmiş hücre tedavileri, hastalık modelleme ve insan yaşlanmasının incelenmesi için büyük bir umut taşımaktadır. Devam eden disiplinlerarası işbirliği ve etik denetim, epigenetik modülasyon aracılığıyla iPSC yenilenmesinin tam terapötik potansiyelini gerçekleştirmek için hayati önem taşımaktadır.