CRISPR-Cas9 表观遗传调控如何革新诱导多能干细胞 (iPSC) 的年轻化——深入探讨科学及未来潜力
- iPSC年轻化与表观遗传调控简介
- CRISPR-Cas9:表观遗传编辑的机制与创新
- iPSC年轻化的关键表观遗传靶点
- 近期进展:案例研究与实验结果
- CRISPR-Cas9 表观遗传调控中的挑战与局限性
- 治疗意义与再生医学应用
- 伦理考虑与监管环境
- 未来方向:新兴技术与研究前沿
- 结论:通过 CRISPR-Cas9 实现 iPSC年轻化的未来之路
- 来源与参考文献
iPSC年轻化与表观遗传调控简介
诱导多能干细胞 (iPSCs) 是经过重编程的体细胞,能够转化为各种细胞类型,具有巨大的再生医学和疾病建模潜力。然而,iPSCs 通常保留来自其来源细胞的残余表观遗传记忆,这可能限制它们的完全年轻化和分化潜力。表观遗传调控——在不改变基础遗传密码的情况下改变 DNA 或组蛋白上的化学修饰——已成为增强 iPSC 年轻化的有前景策略,通过将这些表观遗传标记重置为更胚胎样的状态。
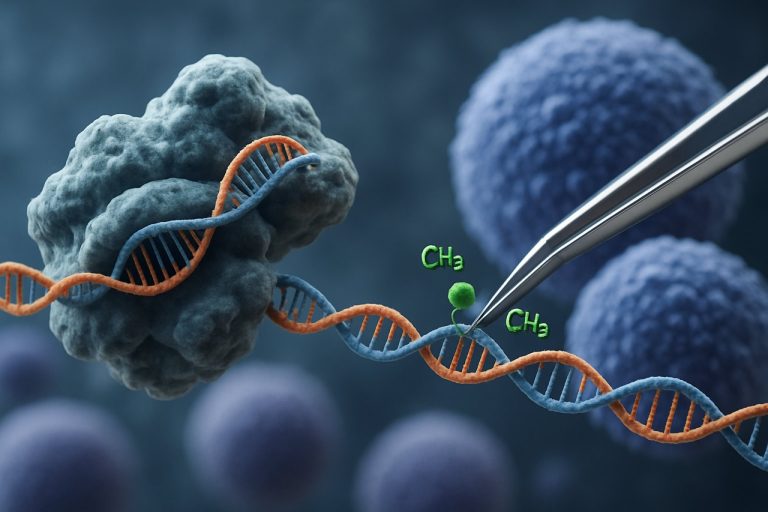
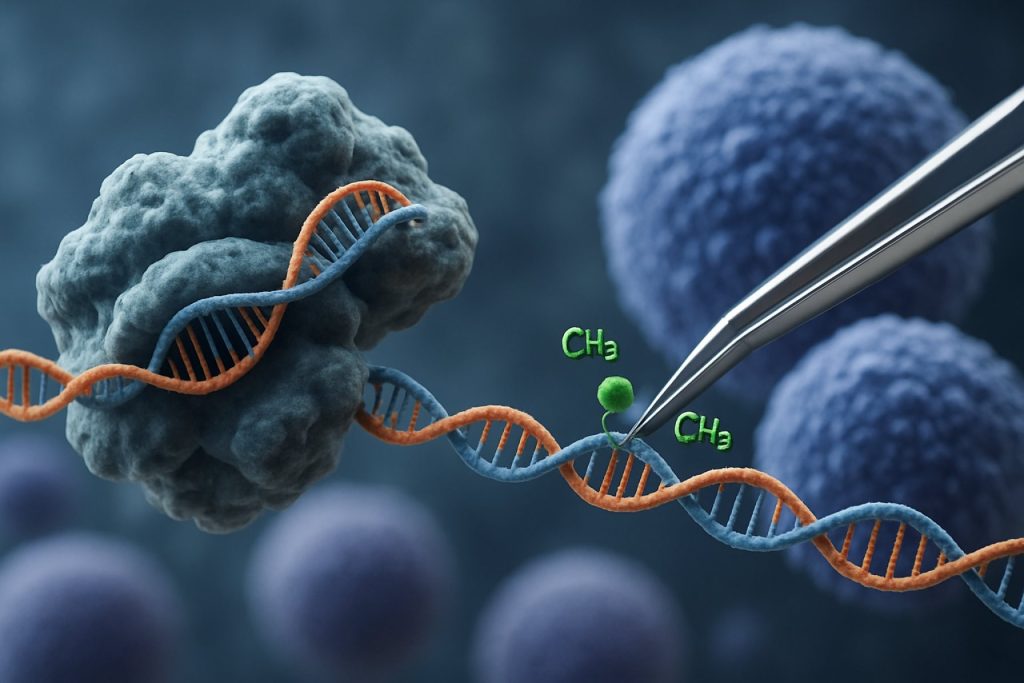
CRISPR-Cas9 技术的出现彻底改变了表观遗传编辑领域。与传统的 CRISPR 应用通过引入双链断裂进行基因编辑不同,基于 CRISPR 的表观遗传调控使用与表观遗传效应域融合的催化失活 Cas9 (dCas9)。该系统允许对表观遗传标记(如 DNA 甲基化或组蛋白乙酰化)进行精确的位点特异性修改,从而实现对 iPSCs 中基因表达谱的靶向重编程。这种靶向干预可以消除与年龄相关或谱系特异的表观遗传特征,促进 iPSCs 的更全面年轻化并改善其功能特性。
最近的研究表明,使用 CRISPR-dCas9 系统调节与年轻化相关的关键基因和表观遗传调节因子的可行性,为更高效且安全的干细胞治疗铺平了道路。随着该领域的发展,将 CRISPR-Cas9 表观遗传调控与 iPSC 技术相结合,具有克服细胞重编程当前局限性和开发个性化再生医学方法的重大潜力(Nature Reviews Genetics, Cell Stem Cell)。
CRISPR-Cas9:表观遗传编辑的机制与创新
CRISPR-Cas9 系统最初是为精确基因组编辑而开发的,已创新性地适应于靶向表观遗传调控,为诱导多能干细胞 (iPSCs) 的年轻化提供了新的途径。与传统的 CRISPR-Cas9 不同,后者通过引入双链断裂来编辑 DNA 序列,表观遗传编辑使用与表观遗传效应域融合的催化失活 Cas9 (dCas9)。这允许对染色质状态进行位点特异性修改——如 DNA 甲基化或组蛋白乙酰化——而不改变基础遗传密码。这种精确性对于 iPSC 年轻化至关重要,因为重置表观遗传景观可以恢复年轻的基因表达谱,并增强细胞功能。
最近的创新包括与 DNA 甲基转移酶或去甲基酶以及组蛋白乙酰转移酶或去乙酰酶融合的 dCas9,使得可以可逆地激活或抑制与衰老和衰退相关的目标基因。例如,靶向去甲基化多能性基因的启动子可以重新激活其表达,提高 iPSC 的质量和分化潜力。此外,已证明多重表观遗传编辑——同时靶向多个位点——进一步增强了年轻化过程,通过协调复杂的基因调控网络 Nature Reviews Genetics。
这些进展得到了改进的递送系统的支持,如核糖核蛋白复合物和病毒载体,这些系统提高了编辑效率并减少了脱靶效应。总的来说,基于 CRISPR-Cas9 的表观遗传编辑代表了一种变革性的方法,用于 iPSC 年轻化,具有克服传统重编程局限性并为再生治疗铺平道路的潜力 Cell Stem Cell。
iPSC年轻化的关键表观遗传靶点
利用 CRISPR-Cas9 进行诱导多能干细胞 (iPSC) 年轻化的表观遗传调控的关键方面是识别和靶向控制细胞老化和多能性的关键表观遗传调节因子。在最突出的靶点中,有 DNA 甲基化模式、组蛋白修饰和非编码 RNA 位点,这些都在重编程过程中发挥着重要作用,维护或消除细胞记忆。例如,已知衰老标记 p16INK4a 启动子的甲基化状态会影响 iPSC 的增殖能力和年轻化潜力。与 DNA 去甲基酶或甲基转移酶融合的 CRISPR-dCas9 系统可以精确靶向这些位点,以调节其表观遗传状态,从而提高重编程效率和细胞年轻化 Nature Reviews Genetics。
另一个关键靶点是组蛋白修饰的调控,例如与异染色质形成和基因沉默相关的 H3K9me3 和 H3K27me3。使用与组蛋白修饰酶融合的 CRISPR-dCas9 在特定基因组区域靶向编辑这些标记可以重新激活多能性基因或抑制与衰老相关的基因,从而促进更强大的年轻化过程 Cell Stem Cell。此外,调节染色质结构和基因表达的长非编码 RNA (lncRNA) 正在成为微调 iPSC 表观遗传景观的有前景的 CRISPR 靶点 Nature Cell Biology。
总体而言,使用基于 CRISPR-Cas9 的工具战略性选择和精确调节这些表观遗传靶点对于推进 iPSC 年轻化和再生治疗的发展具有重要潜力。
近期进展:案例研究与实验结果
近年来,在利用基于 CRISPR-Cas9 的表观遗传调控来年轻化诱导多能干细胞 (iPSCs) 方面取得了显著进展。值得注意的是,几项研究已证明使用与表观遗传修饰剂融合的催化失活 Cas9 (dCas9) 来靶向和重塑特定染色质区域的可行性,从而逆转 iPSCs 中与年龄相关的表观遗传标记。例如,Nature 的一项开创性研究报告了使用 dCas9-TET1 去甲基化关键多能性基因的启动子区域,结果提高了重编程效率并改善了细胞年轻化标记。
Cell Stem Cell 发表的另一项重要实验利用 dCas9-p300 在与年轻基因表达谱相关的位点上乙酰化组蛋白 H3K27。这种靶向表观遗传编辑不仅恢复了年轻的转录特征,还改善了来自老年供体的 iPSCs 的线粒体功能,并减少了与衰老相关的表型。
此外,Science 最近的一项临床前研究表明,多重 CRISPR-dCas9 表观遗传编辑可以同时调节多个与衰老相关的通路,从而对 iPSC 年轻化产生协同效应。这些发现共同强调了 CRISPR-Cas9 表观遗传调控作为一种精确且多功能工具的潜力,用于逆转 iPSCs 中的细胞老化,为未来在再生医学和与年龄相关的疾病建模中的应用铺平道路。
CRISPR-Cas9 表观遗传调控中的挑战与局限性
尽管基于 CRISPR-Cas9 的表观遗传调控在年轻化诱导多能干细胞 (iPSCs) 方面具有变革潜力,但仍然存在一些挑战和局限性。一个主要问题是脱靶效应,即 CRISPR-Cas9 系统可能意外地结合并修改意图外的基因组位点,可能导致不可预测的表观遗传变化和基因组不稳定性。这在 iPSC 年轻化的背景下尤其关键,因为即使是轻微的脱靶修改也可能妨碍多能性或触发致癌通路 Nature Reviews Genetics。
另一个局限性在于表观遗传编辑的效率和特异性。虽然与表观遗传修饰剂融合的催化失活 Cas9 (dCas9) 可以靶向特定位点,但表观遗传变化的程度和持久性——如 DNA 甲基化或组蛋白修饰——往往是可变的,可能无法完全重现强大 iPSC 年轻化所需的年轻表观遗传景观 Cell Stem Cell。此外,将 CRISPR-dCas9 组件递送到 iPSCs 仍然在技术上具有挑战性,病毒载体存在插入突变的风险,而非病毒方法往往效率低下。
免疫原性是另一个关注点,因为引入外源性蛋白(如 Cas9)可能引发免疫反应,特别是在临床应用中。此外,经过表观遗传修饰的 iPSCs 的长期稳定性和安全性尚未完全建立,提出了关于其适用于治疗用途的问题 U.S. Food & Drug Administration。解决这些挑战对于安全有效地将 CRISPR-Cas9 表观遗传调控策略转化为 iPSC 年轻化至关重要。
治疗意义与再生医学应用
在诱导多能干细胞 (iPSC) 年轻化中应用基于 CRISPR-Cas9 的表观遗传调控具有重要的治疗干预和再生医学前景。通过精确靶向和修改表观遗传标记——如 DNA 甲基化和组蛋白修饰——在特定基因组位点,研究人员可以逆转 iPSCs 中与年龄相关的表观遗传变化,从而增强它们的多能性、基因组稳定性和分化潜力。这一年轻化过程对于生成适合细胞替代治疗、疾病建模和药物筛选的高质量 iPSCs 至关重要。
在再生医学中,年轻化的 iPSCs 可以分化为各种功能更强且衰老或肿瘤发生风险降低的细胞类型,从而解决临床应用中的主要安全问题。例如,对涉及细胞老化的基因(如 p16INK4a 或 TERT)进行表观遗传编辑可以恢复年轻的基因表达谱和端粒长度,提高衍生细胞的治疗效果。此外,结合表观遗传修饰剂的 CRISPR-dCas9 融合蛋白能够可逆地进行位点特异性调节,最小化脱靶效应和永久基因组改变,这对于临床转化至关重要 Nature Reviews Genetics。
年轻化患者来源的 iPSCs 的能力还为个性化再生疗法开辟了新途径,其中自体细胞可以被年轻化,纠正导致疾病的突变,并分化为功能性组织以进行移植。这种方法有潜力治疗广泛的退行性疾病,包括神经退行性疾病、心血管疾病和糖尿病,通过提供可再生的年轻、患者特异性细胞 Cell Stem Cell。随着技术的成熟,将 CRISPR-Cas9 表观遗传调控与基于 iPSC 的疗法结合,可能会彻底改变再生医学的格局。
伦理考虑与监管环境
在诱导多能干细胞 (iPSC) 年轻化中应用 CRISPR-Cas9 媒介的表观遗传调控面临重大伦理和监管挑战。与传统基因编辑不同,表观遗传调控并不改变 DNA 序列,而是通过可逆变化(如 DNA 甲基化或组蛋白修饰)来修改基因表达。虽然这可能减少与永久基因改变相关的一些担忧,但长期影响和潜在的脱靶影响仍然不确定,提出了关于临床应用中的安全性和意外后果的问题。
在伦理上,CRISPR-Cas9 在 iPSC 年轻化中的使用与人类增强、同意以及如果年轻化细胞用于生育背景下的生殖系传播的潜力等问题交叉。人们还担心对这种先进疗法的公平获取,这可能加剧现有的健康差距。创造“设计”细胞或组织的可能性进一步复杂化了伦理环境,迫切需要强有力的监督和公众参与。
针对基于 CRISPR 的表观遗传干预的监管框架仍在不断发展。在美国,U.S. Food and Drug Administration 监管基因治疗和细胞产品,但针对表观遗传编辑的具体指南仍在制定中。欧洲药品管理局 同样监管先进治疗药物,包括涉及基因组和表观基因组编辑的产品。在国际上,世界卫生组织 呼吁制定全球标准和治理,以应对这些技术带来的独特风险和伦理困境。
随着研究的进展,科学家、伦理学家、监管者和公众之间的持续对话将对确保负责任的创新以及 CRISPR-Cas9 表观遗传调控在 iPSC 年轻化中的安全、公平应用至关重要。
未来方向:新兴技术与研究前沿
CRISPR-Cas9 表观遗传调控在诱导多能干细胞 (iPSC) 年轻化中的未来有望实现重大进展,受新兴技术和新研究前沿的推动。一种有前景的方向是将基于 CRISPR 的表观遗传编辑与单细胞多组学结合,能够在单细胞水平上精确映射和操控染色质状态、DNA 甲基化和组蛋白修饰。这种方法可以揭示 iPSC 群体的异质性,并优化年轻化方案以增强细胞功能和寿命 Nature Reviews Genetics。
另一个前沿是开发下一代 CRISPR 系统,如碱基编辑器和引导编辑器,这些系统允许在不引入双链断裂的情况下进行更精细和可逆的表观遗传修改。这些工具可能最小化脱靶效应和基因组不稳定性,解决临床应用中的关键安全问题 Cell Stem Cell。此外,正在探索使用可编程表观遗传效应因子,如与染色质修饰酶融合的 dCas9,以重置与衰老相关的表观遗传标记并恢复 iPSCs 中年轻的基因表达谱 Science。
展望未来,人工智能与机器学习与 CRISPR 技术的结合预计将加速年轻化靶点的识别和预测最佳编辑策略。此外,基于纳米颗粒或无病毒方法的递送系统的进步将提高 iPSCs 中表观遗传编辑的效率和安全性。这些创新共同具有革命性再生医学和与年龄相关的疾病建模的潜力,通过实现精确、安全和持久的 iPSC 年轻化 Nature Biotechnology。
结论:通过 CRISPR-Cas9 实现 iPSC年轻化的未来之路
CRISPR-Cas9 媒介的表观遗传调控在诱导多能干细胞 (iPSCs) 年轻化中的应用代表了再生医学的变革前沿。通过实现精确的位点特异性表观遗传标记编辑,这项技术提供了重置与年龄相关的分子特征、提高 iPSC 质量和改善其治疗效用的潜力。最近的进展已经证明靶向关键表观遗传调节因子以恢复 iPSCs 中年轻的基因表达谱和功能能力的可行性,从而解决残余表观遗传记忆和不完全重编程等局限性 Nature Reviews Genetics。
展望未来,若干挑战和机遇定义了临床转化的道路。确保 CRISPR 基于表观遗传编辑的特异性和安全性仍然至关重要,因为脱靶效应和意外的染色质改变可能会妨碍细胞功能或安全性 U.S. Food & Drug Administration。开发具有更高保真度的下一代 CRISPR 工具以及强大的递送系统,对于推动这一领域至关重要。此外,整合多组学方法以监测和验证年轻化结果,将增强我们对潜在机制的理解,并促进监管批准 National Human Genome Research Institute。
最终,CRISPR-Cas9 技术与 iPSC 生物学的结合对个性化细胞疗法、疾病建模和人类衰老研究具有巨大的潜力。持续的跨学科合作和伦理监督将是实现通过表观遗传调控实现 iPSC 年轻化的全部治疗潜力的关键。